
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основы количественного анализа
|
|
|
|
О Т В Е Т Ы
1. ç 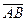 ç=3;
ç=3; 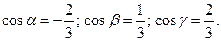
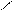 2.
2. 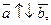 ç
ç 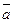 ç=3 ç
ç=3 ç 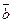 ç. 3.
ç. 3. 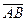 çç
çç 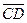 ,
, 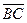 çç
çç 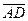 .
.
4. 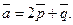
5. 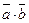 =-10. 6.
=-10. 6. 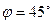 .
.
7. 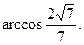 8.
8. 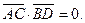
9. 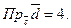 10.
10. 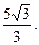 11. 15.
11. 15.
12. ç 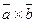 ç=
ç= 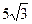 ;
; 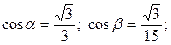
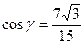
13. 16. 14. 1) 27; 2) 243.
15. 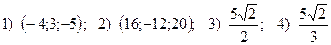 .
.
16. 1) 1; 2) 5. 17. 
18. 1) Да; 2) нет; 3) да.
19. 
20. 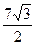 . 21. 54.
. 21. 54.
22.  .
.
23. 1) Нет; 2) да.
24. 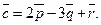
25. 1) -6; 2) 13; 3) -61; 4) 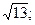 5)
5) 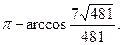
26. 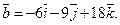
27. 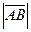 =ç
=ç 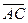 ç;
ç; 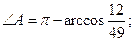

28. 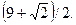
29. 1) 68; 2) 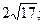 3)
3) 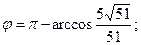 4)
4) 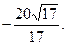
30. 1) 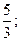 2)
2)  31. 1) 168; 2) 36.
31. 1) 168; 2) 36.
32. 1) 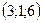 , 2)
, 2) 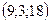 , 3)
, 3) 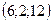 , 4)
, 4) 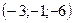 .
.
33.  . 34.
. 34. 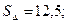
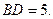
35. 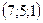 . 36. 1) –6; 2) 2.
. 36. 1) –6; 2) 2.
37. 7. 38. 24.
39. 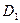 (0;0;–1),
(0;0;–1), 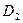 (0;0;11).
(0;0;11).
40. 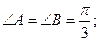
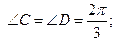

Задачей аналитической химии является разработка методов определения состава различных объектов, как природного, так и искусственного происхождения. Методы химического анализа включают качественный анализ – идентификация (обнаружение) компонентов анализируемого объекта и количественный анализ – определение содержания (массы, концентрации) или количественного соотношения компонентов в анализируемом объекте.
Методы количественного анализа широко применяются во всех областях деятельности человека, в том числе в биохимии и медицине, где диагностика многих заболеваний основана на сравнении результатов анализа крови, мочи, желудочного сока, спинномозговой жидкости и др., взятых у конкретного больного, с нормальным содержанием определяемых компонентов в этих биожидкостях. Количественный анализ используется также при определении качества пищевых продуктов, питьевой воды, лекарственных препаратов и др.
Методы количественного анализа. Методы количественного анализа моно разделить на химические и физико-химические. Химические методы основаны на проведении химических реакций между изучаемым объектом и специально подобранным реактивом. Объектом как правило служит раствор. Определение проводится по количеству затраченного реактива или по количеству полученного продукта реакции. Различают гравиметрический и титриметрический методы анализа. Гравиметрический анализ основан на полном количественном выделении компонента раствора (как правило, в виде осадка) и последующем его взвешивании. Титриметрический анализ заключается в точном определении объема раствора реактива с известной концентрацией, необходимого для полного протекания реакции с данным объемом анализируемого раствора.
Физико-химические методы анализа – это аппаратурные методы, основанные на количественном изучении зависимости «состав – физическое свойство объекта». К ним относится потенциометрия, кулонометрия, спектрофотометрия и другие.
Вне зависимости от метода количественный анализ включает следующие этапы: отбор и подготовка пробы для анализа; перевод анализируемой части пробы в состояние, удобное для анализа; расчет результата единичного определения; расчет результата анализа путем усреднения результатов единичных определений.
Теоретические основы титриметрического анализа. Титриметрия – совокупность методов количественного анализа, основанных на измерении количества реагента, необходимого для взаимодействия с определяемым веществом в растворе в соответствии со стехиометрией химической реакции между ними.
В основе титриметрического метода анализа лежит один из законов стехиометрии – закон эквивалентов.
Химическим эквивалентом называется реальная или условная частица вещества, в обменной реакции присоединяющая или замещающая один однозарядный ион (протон), а в окислительно-восстановительной реакции – участвующая в переносе одного электрона. Химический эквивалент вещества Х обозначается  .
.
В обменных реакциях:
Al2(SO4)3 + 3 BaCl2 → 2 AlCl3 + 3 BaSO4
H3PO4 + 2 KOH → K2HPO4 + 2 H2O
эквиваленты реагирующих веществ равны:
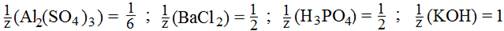
Фактор эквивалентности  показывает, какая часть структурной или формульной единицы вещества соответствует ее эквиваленту в данной реакции.
показывает, какая часть структурной или формульной единицы вещества соответствует ее эквиваленту в данной реакции.
Для окислительно-восстановительной реакции:
2 KMnO4 + 5 H2O2 + 3 H2SO4 → 2 MnSO4 + 5 O2 + K2SO4 + 8 H2O
эквивалент перманганата калия (MnO4 - + 8Н+ + 5 е - → Mn2+ + 4 H2O) равен 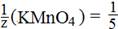
а эквивалент пероксида водорода (H2O2 – 2 е -→ O2 + 2Н+) равен
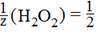
Таким образом, в реакцию вступают равные количества веществ эквовалентоа окислителя и восстановителя:
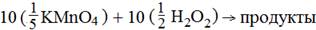
|
|
|
|
|
Дата добавления: 2015-06-25; Просмотров: 1119; Нарушение авторских прав?; Мы поможем в написании вашей работы!