
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон эквивалентов: вещества реагируют друг с другом в равных количествах их эквивалентов
|
|
|
|
Понятие химического эквивалента значительно упрощает расчеты в количественном анализе. Молярную концентрацию и молярную массу эквивалента вещества Х можно рассчитать по формулам:
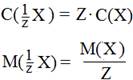
Тогда закон эквивалентов можно записать в виде:
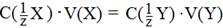 (1.1)
(1.1)
где V(X) и V(Y) – объемы реагирующих веществ Х и Y.
Эта формула позволяет рассчитать концентрацию эквивалента определяемого вещества (анализируемый раствор), если точно известна концентрация реагирующего с ним вещества (титрант). Добавление раствора титранта к анализируемому раствору небольшими порциями (по каплям) называется титрованием. При проведении титрования контролируют объем добавленного титранта. Процесс титрования заканчивается при достижении точки эквивалентности – состояния системы, в котором количества веществ эквивалентов анализируемого вещества (Х) и титранта (Т) становятся равны. Измерив объем титранта рассчитывают концентрацию эквивалента анализируемого вещества, используя (1.1):

Реакции, используемые в титриметрическом анализе, должны осуществляться достаточно быстро, быть практически необратимыми, не сопровождаться образованием побочных продуктов и позволять надежно фиксировать точку эквивалентности.
В зависимости от типа химической реакции выделяют следующие методы титриметрического анализа:
- Кислотно-основное титрование (ацидиметрия, алкалиметрия);
- Окислительно-восстановительное титрование – оксидиметрия (перманганатометрия, иодиметрия, броматометрия);
- Осадительное титрование (аргентометрия, меркуриметрия);
- Комплексометрическое титрование (комплексометрия, комплексонометрия);
По способам титрования различают: прямое титрование, когда к раствору анализируемого вещества непосредственно добавляют раствор титранта; при обратном титровании к раствору анализируемого вещества добавляют строго определенное количество вспомогательного реагента, избыток которого титруют раствором титранта; при косвенном титровании к раствору анализируемого вещества добавляют нефиксированный избыток вспомогательного реактива с последующим титрованием продукта реакции раствором титранта.
Кислотно-основные реакции в титриметрическом анализе. Определение веществ с применением в качестве титрантов стандартных растворов кислот называется ацидиметрия, а с применением растворов щелочей – алкалиметрия. Ацидиметрическим титрованием можно определить содержание в растворе сильных и слабых оснований, а также солей, образованных слабыми кислотами и гидролизующихся по аниону. Точка эквивалентности в этих случаях находится в кислой среде, в области рН≤7. Алкалиметрически можно определить содержание в растворе сильных и слабых кислот, а также солей, образованных слабыми основаниями и гидролизующихся по катиону. Точка эквивалентности в этих случаях находится в щелочной среде, в области
рН ≥7.
Зависимость рН (или какого-либо другого физического свойства) от объема добавленного титранта называется кривой титрования, на ней фиксируется скачок – резкое изменение свойства – в точке эквивалентности (рис.1).
Точка эквивалентности определяется, как правило, визуально по изменению окраски раствора. Часто для этих целей используют кислотно-основные индикаторы – органические соединения, которые изменяют окраску в зависимости от концентрации ионов Н+, то есть от рН раствора. Изменение цвета индикатора отмечается в области рН, которая называется интервалом перехода индикатора (таблица 2 и таблица 4 приложения). Индикатор подбирают так, чтобы интервал перехода окраски включал значение рН, которое должен иметь раствор в точке эквивалентности (рис. 1). Смеси индикаторов, которые непрерывно изменяют окраску во всей области рН от 1 до 14, называются универсальными. Их используют для приблизительной оценки рН растворов.
Оборудование и методика проведения титриметрического анализа. Основным оборудованием в титриметрическом анализе является мерная химическая посуда – бюретки, мерные пипетки, мерные и конические колбы (рис.2). Мерная посуда обязательно должна иметь маркировку с указанием вместимости (в мл), которая реализуется при наполнении жидкостью при указанной температуре.
Бюретка представляет собой калиброванную стеклянную трубку с клапанным устройством на оттянутом конце, предназначенную для добавления растворов небольшими порциями или каплями и измерения объема. Цена бюретки вместимостью 25 мл или 50 мл составляет 0,1 мл. Заполняется бюретка раствором через верхнее отверстие с помощью воронки. Мерные пипетки – это стеклянные трубки, предназначенные для отмеривания и переноса заданного объема раствора для проведения анализа – аликвотной доли – из одного сосуда в другой. Пипетка может быть рассчитана на отмеривание одного объема (пипетка Мора) или на любой объем в пределах вместимости (градуированная пипетка). Для заполнения пипеток используют медицинские груши. Мерные колбы представляют собой плоскодонные колбы с узким горлышком, на которое нанесена кольцевая метка. Мерные колбы предназначены для приготовления растворов точно заданного объема. Конические колбы – плоскодонные колбы, предназначенные для непосредственного проведения реакций.
Этапы выполнения титриметрического анализа показаны на рисунке 3. Анализируемый раствор переносят в мерную колбу (1) и добавляют дистиллированную воду строго до метки. Из мерной колбы с помощью пипетки Мора отбирают аликвотную долю анализируемого раствора (2) и переносят в коническую колбу для титрования (3). Перед началом титрования в колбу при необходимости добавляют вспомогательные растворы или индикатор. Титруют (4) анализируемый раствор в конической колбе раствором титранта из бюретки, предварительно заполнив ее до нулевой метки. Следует помнить, что заполнение бюретки и измерение объемов для неокрашенных или слабоокрашенных жидкостей проводят по центру мениска жидкости, а для интенсивноокрашенных жидкостей – по краю мениска.
Задание для самостоятельной подготовки
При подготовке к занятию необходимо усвоить следующие основные понятия:
1) Количественный анализ;
2) Химический эквивалент
3) Закон эквивалентов;
4) Титрование и титрант;
5) Точка эквивалентности и кривая титрования;
6) Основные методы титриметрического анализа и способы титрования;
7) Ацидиметрия и алкалиметрия;
8) Принцип выбора индикатора;
Для подготовки к занятию в качестве основного рекомендован учебник [ ], дополнительно может быть использована литература: [ ]
Контрольные вопросы
- В чем сущность титриметрического метода анализа?
- Дайте определение понятий «титрование», «титрант».
- Сформулируйте закон эквивалентов.
- Рассчитайте факторы эквивалентности фосфорной кислоты, если в результате ее взаимодейсвия с гидроксидом натрия образуются: а) дигидрофосфат натрия; б) фосфат натрия.
- Рассчитайте факторы эквивалентности перманганата калия и щавелевой кислоты в реакции: 2 KMnO4 + 5 H2 С2O4 + 3 H2SO4 → 2 MnSO4 + 10 СO2 + K2SO4 + 8 H2O
- Пользуясь таблицами 2 и 4 Приложения, подберите индикатор для каждого случая ацидиметрического титрования соляной кислотой растворов: а) карбоната натрия; б) аммиака; в) гидроксида калия. Выбор поясните.
- Вычислите объем раствора азотной кислоты с концентрацией 0,065 моль/л, необходимый для титрования раствора, содержащего 0,1 г гидроксида калия.
- Раствор муравьиной кислоты массой 2,32 г разбавлен водой до 100 мл. На титрование 10 мл разбавленного раствора затрачено 7,2 мл раствора гидроксида калия с концентрацией 0,15 моль/л. Рассчитайте массовую долю муравьиной кислоты в исходном растворе.

Рис.1. Кривые титрования: сильного основания (щелочи) сильной кислотой (а) и слабой кислоты сильным основанием (б).
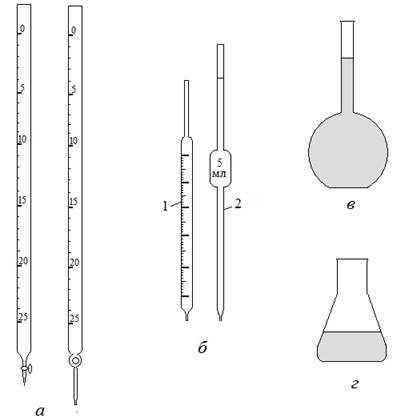
Рис.2. Оборудование для титриметрического анализа: а – бюретки; б – пипетки; в – мерная колба; г – коническая колба.
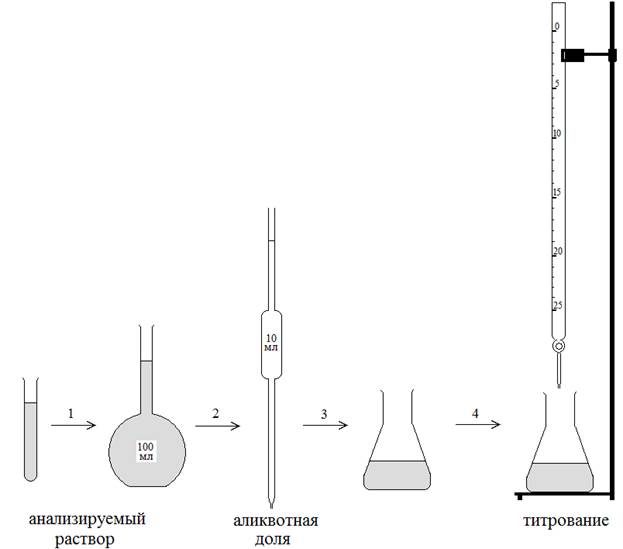
Рис.3. Этапы выполнения титриметрического анализа (пояснения в тексте).
|
|
|
|
|
Дата добавления: 2015-06-25; Просмотров: 5273; Нарушение авторских прав?; Мы поможем в написании вашей работы!