
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод потенциометрического титрования
|
|
|
|
Потенциометрическое титрование – метод, основанный на определении объема титранта, соответствующей точке эквивалентности, по перегибу кривой титрования и расчете концентрации определяемого вещества. Кривую титрования строят по значениям потенциала индикаторного электрода в анализируемом растворе, измеренным после каждой порции добавленного титранта. Подобно классическим объемным методам титрования потенциометрический метод применим к реакциям осаждения, нейтрализации, комплексообразования и окисления-восстановления.
При проведении окислительно-восстановительных реакций чаще всего в качестве индикаторного электрода используют платиновый (окислительно-восстановительный) электрод, погруженный в раствор электролита, содержащего окисленную и восстановленные формы вещества, участвующего в реакции. Например, раствор электролита содержит ионы железа (III) и (II), в этом случае окислительно-восстановительный электрод можно схематично изобразить так:
Pt | Fe3+, Fe2+, (Б.6)
электродную реакцию записать:
Fe3+ + e = Fe2+, (Б.7)
а уравнение для электродного потенциала:
E 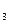 = E
= E 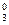 +
+ 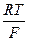 ln
ln 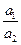 (2.6)
(2.6)
где E 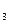 – значение потенциала окислительно-восстановительного электрода СВЭ, В; E
– значение потенциала окислительно-восстановительного электрода СВЭ, В; E 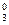 – значение стандартного потенциала окислительно-восстановительного электрода относительно СВЭ, В; a
– значение стандартного потенциала окислительно-восстановительного электрода относительно СВЭ, В; a 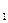 – активность ионов железа (III) в растворе; a
– активность ионов железа (III) в растворе; a 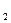 – активность ионов железа (II) в растворе.
– активность ионов железа (II) в растворе.
Как видно из уравнения (2.6), потенциал окислительно-восстановительного электрода Е3 зависит от отношения активностей ионов железа различных степеней окисления. Если раствор разбавленный, то значения активностей ионов в уравнении (2.6) можно заменить на величины их концентраций:
E 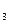 = E
= E 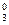 +
+ 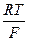 ln
ln 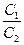 (2.7)
(2.7)
Более сложный электродный процесс протекает на поверхности платины, погруженной в раствор, содержащий, например, ионы марганца различной степени окисления (VII) и (II). В этом случае электродная реакция сопровождается не только изменением величины заряда иона, но и изменением его состава:
MnO4- + 8H+ + 5e = Mn2+ + 4H2O. (Б.8)
E 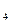 = E
= E 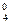 +
+ 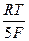 ln
ln 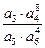 , (2.8)
, (2.8)
где E 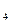 – значение потенциала окислительно-восстановительного электрода СВЭ, В; E
– значение потенциала окислительно-восстановительного электрода СВЭ, В; E 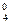 – значение стандартного потенциала окислительно-восстановительного электрода относительно СВЭ, В; a
– значение стандартного потенциала окислительно-восстановительного электрода относительно СВЭ, В; a 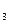 – активность ионов марганца (VII) в растворе; a
– активность ионов марганца (VII) в растворе; a 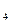 – активность ионов водорода в растворе; a
– активность ионов водорода в растворе; a 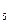 – активность ионов марганца (II) в растворе; а
– активность ионов марганца (II) в растворе; а 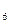 – активность воды.
– активность воды.
Если активность ионов водорода и активность воды в растворе принять равными единице, т. е. а 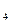 = 1, а
= 1, а 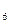 = 1,то величина потенциала окислительно-восстановительного электрода зависит только от отношения активностей ионов марганца различных степеней окисления:
= 1,то величина потенциала окислительно-восстановительного электрода зависит только от отношения активностей ионов марганца различных степеней окисления:
E 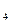 = E
= E 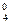 +
+ 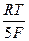 ln
ln 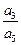 . (2.9)
. (2.9)
Если раствор разбавленный, то значения активностей ионов в уравнении (2.9) можно заменить на их концентрации в растворе:
E 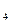 = E
= E 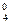 +
+ 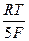 ln
ln  , (2.10)
, (2.10)
где С 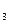 и С
и С 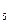 – концентрации ионов железа (III) и (II) соответственно.
– концентрации ионов железа (III) и (II) соответственно.
Рассмотренный окислительно-восстановительный электрод можно схематично изобразить так:
Pt | MnO4-, Mn2+ (Б.9)
Для определения концентрации ионов железа (II) в растворе методом потенциометрического титрования необходимо составить электрохимическую цепь, включающую окислительно-восстановительный электрод и электрод сравнения:
(-) Ag, AgCl | KCl || Fe2+, Fe3+ | Pt (+), (Б.10)
и измерять ЭДС цепи (Б.10) после каждой порции добавленного титранта – раствора перманганата калия.
В результате протекания реакции:
5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O (Б.11)
происходит уменьшение содержания ионов Fe2+ в растворе и увеличение концентрации ионов Fe3+, что влияет на величину потенциала индикаторного электрода Е3 и ЭДС в целом. После точки эквивалентности в растворе появляется избыток ионов MnO4- и измеряемая ЭДС уже соответствует электрохимической цепи:
(-) Ag, AgCl | KCl || Mn2+, MnO4- | Pt (+), (Б.12)
а потенциал индикаторного электрода зависит от отношения концентраций ионов Mn2+, MnO4- в растворе.
Если считать, что в процессе титрования не происходит изменение объема реакционной смеси, то текущую концентрацию ионов железа (II) и (III) до точки эквивалентности можно выразить через исходную концентрацию ионов железа (II) в растворе C2 и отношение эквивалентов реагирующих веществ в растворе y:
y = N 2 ×V 2 /N 1 V 1, (2.11)
где N 1 – нормальность исходного раствора, содержащего ионы железа Fe2+; V 1 – объем исходного раствора, взятого на титрование; N 2 - нормальность раствора перманганата калия; V 2 – объем титранта.
Концентрация ионов железа (II) в этом случае будет равна C 2×(1 – y), – ионов железа (III) – C 2× y. Тогда уравнение, характеризующее значение потенциала индикаторного электрода Е3 в процессе титрования до точки эквивалентности будет иметь вид:
E 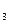 = E
= E 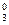 +
+ 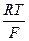 ln
ln 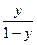 (2.12)
(2.12)
Таким образом, потенциал индикаторного электрода Е3 относительно СВЭ в процессе титрования до точки эквивалентности может быть рассчитан через отношение эквивалентов реагирующих веществ y.
Концентрация ионов марганца (II), выраженная через нормальность титранта и его объем в точке эквивалентности, равна N 2× V 2ТЭ/ V 1. Эта величина остается постоянной при дальнейшем титровании.
После точки эквивалентности в растворе появляется избыток ионов MnO4-, концентрация которых, выраженная через нормальность титранта и его объем, равна N 2×(V 2 – V 2ТЭ)/ V 1. Тогда потенциал индикаторного электрода Е4 описывается уравнением:
E 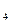 = E
= E  +
+ 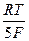 ln(y - 1). (2.13)
ln(y - 1). (2.13)
Таким образом, и после точки эквивалентности потенциал индикаторного электрода может быть также рассчитан через отношение эквивалентов реагирующих веществ y.
Точка эквивалентности реакции (Б.11) соответствует тому моменту, когда к ионам железа Fe2+ добавлено эквивалентное количество ионов MnO4-, т. е. С2/ С 3 = С 1/ С 5 = 5/1 и Е 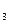 = Е
= Е 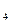 . Применяя уравнение Нернста к электроду Fe3+/Fe2+ в точке эквивалентности, получим:
. Применяя уравнение Нернста к электроду Fe3+/Fe2+ в точке эквивалентности, получим:
EТЭ = E 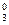 +
+ 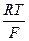 ln(
ln(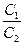 )ТЭ (2.14)
)ТЭ (2.14)
Для электрода MnO4-/Mn2+ в точке эквивалентности уравнение Нернста примет вид:
EТЭ = E  –
– 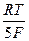 ln (
ln (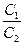 )ТЭ (2.15)
)ТЭ (2.15)
Умножая уравнение (2.15) на пять и суммируя их, получим:
(1 +5)×ЕТЭ = Е 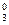 + 5Е
+ 5Е  (2.16)
(2.16)
или
ЕТЭ = 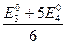 (2.17)
(2.17)
Таким образом, потенциал окислительно-восстановительного электрода в точке эквивалентности является средним арифметическим из стандартных потенциалов двух окислительно-восстановительных электродов.
Результаты расчета кривой потенциометрического титрования для случая титрования 0,1 н раствора FeSO4 0,1 н раствором KMnO4 приведены на рис.8. Как видно из рис. 8, до точки эквивалентности происходит увеличение значения потенциала индикаторного электрода. В точке эквивалентности наблюдается его скачкообразное изменение. После точки эквивалентности потенциал индикаторного электрода практически не меняется.
|
|
|
|
|
Дата добавления: 2015-06-26; Просмотров: 2042; Нарушение авторских прав?; Мы поможем в написании вашей работы!