
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Анализ V и VI аналитических групп
|
|
|
|
III. Систематический анализ смеси
II. Дробный анализ смеси катионов
I. Предварительные испытания
a) Определение цвета раствора- цвет раствора голубой из-за присутствия Cu2+ ,остальные катионы бесцветные;
b) Наличие осадка в предлагаемой смеси – осадка нет, так как соли представлены в ионном виде;
c) Определение рН среды – определить рН среду затруднительно, так как неизвестны кислотные осадки соответствующих солей.
Дробный анализ отсутствует, так как в смеси нет катионов Fe2+,Fe3+.
ДобавляемNaOH +3% H2O2 – групповой реактив IV группы катионов, чтобы отделить ее от V и VI.
Ч.з.к.(13-15 капель) + NaOH +3% H2O2 →
VI гр Cu(OH)2(голубой)
Раствор IV гр SnO32- (бесцв.)
К раствору SnO32- + HCl pH=1 Sn4+
Получаем раствор Sn4+ + NH4OHконц. pH=9
Получаем осадок Sn(OH)4 бел +HCl
+ Hg(NO3 )2→↓ 2Hg2Cl2→↓ Hg черный + Sn4+
Раствор Sn4+ + Fe0 t Sn2+
+ KOH→ K2SnO2 +BiCl3 →↓Bi0 черный +K2SnO3
Вывод: в пробирках выпали черные осадки, что свидетельствует о присутствии ионов Sn2+ .
Анализ осадка V, VI аналитических групп производят путем растворения в растворе HCl
↓ Vгр Mg(OH)2 , SbO(OH)3
+ HCl t
↓ VIгр Cu(OH)2
Mg2+ , Sb(V)
Раствор +H2O (в два раза больше) t
Cu2+
Плучаем осадок SbO(OH)3 который отделяем от раствора V, VI групп.
↓ SbO(OH)3(бел.) + HNO3 Sb5+ +F e0 t Sb  +
+ 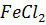
Sb3+ +Sn0 ↓Sb0(черный) + Sn2+
Вывод: в пробирке выпал черный осадок, что свидетельствует о присутствии ионов Sb3+.
Анализ раствора V, VI группы катионов проводят путем отделения V группы от VI действием его группового реактива NH4OHконц.
Vгр Mg2+
Раствор
VI гр Cu2+
Доказываем присутствие катиона Mg2+
Раствор Mg2+ + Na2HPO4 + NH4OH ↓ MgNH4PO4 белый
Вывод: образование белого осадка свидетельствует о присутствии катиона Mg2+ .
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 548; Нарушение авторских прав?; Мы поможем в написании вашей работы!