
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
IV. Реакции, встречаемые по ходу анализа
|
|
|
|
Анализ раствора VI группы
+ 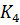 [Fe(
[Fe(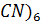 ] ↓Cu2[Fe(CN)6]кирпично-крас.
] ↓Cu2[Fe(CN)6]кирпично-крас.
Cu2+
+ N  OH [Cu(NH3)4]2+ синий раствор
OH [Cu(NH3)4]2+ синий раствор
Вывод: в первой пробирке выпал кирпично-красный, во второй образовался раствор синего цвета, что свидетельствует о присутствии ионов Cu2+.
1. SnCl2 + 4NaOH + H2O2 Na2SnO3 + 2NaCl + 3H2O
1 Sn2+ + 6OH- - 2e SnO32- + 3H2O
1 H2O2 + 2e 2OH-
Sn2+ + 6OH- + H2O2 SnO32- + 3H2O + 2OH-
Sn2+ + 4OH- + H2O2 SnO32- + 3H2O
2. SnCl4 + Fe0 =SnCl2 + FeCl2
1 Sn4++2e Sn2+
1 Fe0-2e Fe2+
3. SnCl2+ 2KOH ↓Sn(OH)2 +2KCl
4.↓ Sn(OH)2 + 2KOH K2SnO2 + 2H2O
5. 3K2SnO2 +2BiCl3 + 6KOH ↓2Bi0черн. + 3K2SnO3 + 6 KCl + 3H2O
2 Bi3+ +3e Bi0
3 SnO22- + 2OH- -2e SnO32- +H2O
2 Bi3+ +3 SnO22-+6OH- 2 Bi0+3 SnO32- +3 H2O
6. MgCl2 + 2NH4OH ↓Mg(OH)2 белый+ 2NH4Cl
Mg2+ +2Cl- +2NH4+ + 2OH- ↓Mg(OH)2 белый +2NH4+ +2Cl-
Mg2+ + 2OH- ↓Mg(OH)2 белый
7. Mg(OH)2 + 2NH4Cl+H2O2 MgCl2+2 NH4OH+H2O
8. MgCl2 + Na2HPO4 + NH4OH ↓ MgNH4PO4 белый + 2NaCl+ H2O
Mg2+ +2Cl- +2Na+ + HPO4 2-+NH4+ +OH- ↓ MgNH4PO4 белый +2Na+ + 2Cl- +H2O
Mg2+ + HPO4 2- + NH4+ +OH- ↓ MgNH4PO4 белый + H2O
9. SbCl5 + Fe0 SbCl3 + FeCl2
1 Sb+5 + 2e Sb+3
1 Fe0 – 2e Fe+2
10. 2SbCl3+3Sn0 2Sb0↓ черный + 3SnCl2
2 Sb+3 +3e Sb0
3 Sn0-2e Sn+2
11. CuSO4 + 4NH4OH [Cu(NH3)4]SO4синий + 4H2O
Cu2+ +SO42- + 4NH4+ +4OH- [Cu(NH3)4]2+ +SO42+ + 4H2O
Cu2+ +4NH4++4OH- [Cu(NH3)4]2+раствор синего цвета +4 H2O
12. 2CuSO4 + K4[Fe(CN)6] Cu2[Fe(CN)6] + K2SO4
2Cu2+ + [Fe(CN)6] 4- Cu2[Fe(CN)6] кирпично-красный
Список использованной литературы
v Харитонов, Ю.Я.
Аналитическая химия (аналитиака).В 2 кн.Кн.1.Общие теоритические основы.Качественный анализ.Учеб.для вузов.-2-изд.,испр.-М.:Высш. шк., 2003.-615 с.,ил.
v Лурье Ю.Ю.
Справочник по аналитической химии.-М.:Химия,1982
v Крешков А.П.
Основы аналитической химии.В 3 частях-м.:Химя,1977
v Пономарев В. Д.
Аналитическая химия(в двух частях).Ч.1.Учебник для фармац. И фак.мед.ин-тов.-М.,Высш.школа,1982.Ч.1.Теоретические основы.Качественный анализ.288с.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 1073; Нарушение авторских прав?; Мы поможем в написании вашей работы!