
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методическая разработка
|
|
|
|
для проведения занятия со студентами II курса
медико-диагностического факультета
по аналитической химии
Тема № 11-12: Кислотно-основное титрование
Время: 3 часа
1. УЧЕБНЫЕ И ВОСПИТАТЕЛЬНЫЕ ЦЕЛИ:
Сформировать знания о сущности и классификации методов титриметрического анализа; привить навыки работы с мерной посудой; обучить производить расчеты в титриметрическом анализе, готовить и стандартизировать растворы соляной кислоты и гидроксида натрия определенной концентрации, выполнять аналитические задачи; ознакомить с ролью титриметрического анализа в медико-биологических исследованиях и клиническом анализе.
МОТИВАЦИЯ ДЛЯ УСВОЕНИЯ ТЕМЫ:
Аналитическая химия – это один из разделов химической науки, предметом которой является разработка методов определения качественного и количественного состава различных объектов, встречающихся в природе или изготовленных искусственным путем. Это могут быть минералы, почва, природные воды, воздух, ткани и органы растений и животных, пищевые продукты. Диагностика множества заболеваний основана на сравнении результатов анализа больного с нормальным содержанием определенных компонентов в крови, моче, желудочном соке, а так же других органах и тканях организма. Поэтому врачам необходимо знать основные принципы и методы аналитической химии.
Различают два вида анализа – качественный и количественный. Задача качественного анализа – обнаружить, какие элементы или их соединения входят в состав анализируемого материала. Качественный анализ обычно предшествует количественному. Цель количественного анализа – определение количественного состава изучаемого объекта.
Основными методами количественного анализа являются гравиметрический (весовой) и титриметрический (объемный). Первый основан на точном измерении массы определяемого вещества, второй – на измерении объемов исследуемых растворов.
Метод кислотно-основного титрования используется для определения кислотности желудочного содержимого, мочи, щелочного резерва крови и плазмы. В токсикологии – для определения аммиака, уксусной, синильной и других кислот. В санитарно-гигиенической практике данный метод позволяет оценить кислотность пищевых продуктов: молока, творога, хлеба и т.д.; оценки промышленных стоков. Кислотно-основной баланс почв важен в оценке объектов окружающей среды.
Титриметрические методы анализа широко используются в медико-биологических исследованиях, поскольку являются быстрыми, удобными, обладают высокой точностью.
ТРЕБОВАНИЯ К ИСХОДНОМУ УРОВНЮ ЗНАНИЙ:
а) способы выражения состава растворов;
б) закон эквивалентов; решение задач с использованием закона эквивалентов;
в) гидролиз солей;
г) понятие о реакции нейтрализации.
В результате проведения занятия студент должен:
1) знать:
· сущность и классификацию методов титриметрического анализа;
· сущность процесса титрования, понятие о точке эквивалентности и способах ее фиксирования;
· понятие о титрантах и способах приготовления титрантов;
· требования, предъявляемые к стандартным веществам;
· реакции, используемые в титриметрическом анализе;
· теоретические основы метода кислотно-основного титрования (нейтрализации);
· роль титриметрического анализа в медико-биологических исследованиях и клиническом анализе.
· 2) уметь:
· проводить расчеты в титриметрическом анализе на основе закона эквивалентов;
· выбрать метод титриметрического анализа при исследованиях, рабочий раствор, стандартный раствор, способ фиксирования точки эквивалентности;
· готовить и стандартизировать растворы соляной кислоты и натрия гидроксида определенной концентрации;
· проводить титрование;
· выполнять аналитические задачи;
· выполнять статистическую обработку полученных данных.
2. СВЯЗЬ СО СМЕЖНЫМИ ДИСЦИПЛИНАМИ:
Полученные знания, умения и навыки потребуются студентам медико-диагностического факультета при анализе биологических объектов.
3. КОНТРОЛЬНЫЕ ВОПРОСЫ ПО ТЕМЕ ЗАНЯТИЯ:
3.1 Способы выражения состава растворов
а) массовая доля вещества;
б) молярная концентрация;
в) молярная концентрация эквивалента;
г) моляльная концентрация;
д) титр;
е) мольная доля.
3.2 Методы количественного анализа.
3.3 Классификация титриметрических методов анализа.
3.4 Основные понятия титриметрического анализа.
3.5 Закон эквивалентов. Расчеты в титриметрическом анализе.
3.6 Метод кислотно-основного титрования (нейтрализации).
а) сущность метода нейтрализации;
б) кислотно-основные индикаторы;
в) кривые кислотно-основного титрования.
4. ПРАКТИЧЕСКАЯ ЧАСТЬ ЗАНЯТИЯ
Лабораторная работа № 1
Установление титра и нормальности рабочего раствора соляной
кислоты по стандартному раствору натрия тетрабората
1. Уравнение реакции, лежащей в основе определения:
При растворении в воде бура сильно гидролизуется по аниону с образованием слабой борной кислоты:
Nа2В4О7 + 7 Н2О ↔ 2 NаОН + 4Н3ВО3
При титровании соляной кислотой равновесие гидролиза смещается практически нацело вправо, т.к. щелочь, выделяющаяся при гидролизе, нейтрализуется кислотой:
NаОН + НСl → NaСl + Н2О
Суммируя эти два уравнения, получаем:
Nа2В4О7 + 2 HCl + 5 Н2О ↔ 2 NаСl + 4 Н3ВО3
2. Выбор индикатора: раствор в точке эквивалентности содержит NаСl и свободную Н3ВО3, которая обуславливает слабокислотную реакцию среды. Поэтому титрование необходимо выполнять в присутствии метилоранжа (таблица 1).
3. Порядок титрования:
а) выливают из бюретки дистиллированную воду, ополаскивают ее изнутри приготовленным раствором НСl и заполняют до нулевой отметки. Следят за тем, чтобы в носике бюретки не было пузырьков воздуха. Бюретку устанавливают в штативе строго вертикально;
б) готовят пробы раствора натрия тетрабората для титрования. Из общей лабораторной склянки в чистую сухую колбу переносят около 50 мл раствора. Для ополаскивания аналитической пипетки ее заполняют раствором, который затем сливают. Подготовленной таким образом пипеткой переносят по 10 мл раствора в каждую из трех колб для титрования. В каждую колбу добавляют по 1-2 капли метилоранжа;
в) титруют раствор натрия тетрабората раствором HCl из бюретки. Первое титрование носит ориентировочный характер. Добавляя небольшими порциями из бюретки титрант, постоянно перемешивают содержимое колбы. Титрование заканчивают, когда от 1 капли титранта произойдет изменение окраски из желтой в оранжевую. Результаты записывают в таблицу. Второе и последующие титрования проводят более точно. Сначала в колбу для титрования быстро добавляют титрант в объеме, меньшем на 0,5 мл объема, определенного при ориентировочном титровании. Затем титрант добавляют по каплям, внимательно следя за изменением окраски раствора. Титрование прекращают, когда заметное изменение окраски происходит при добавлении всего одной капли.
Титрование повторяют до тех пор, пока не будет получено три сходящихся, т.е. отличающихся друг от друга не более чем на 0,1 мл, результата. Все результаты заносят в таблицу.
Таблица 1
Результаты титрования рабочего раствора
HCl стандартным раствором Nа2В4О7
| № | Объем раствора Nа2В4О7 , мл | Объем раствора HCl, мл | Средний объем раствора HCl, мл | Сн HCl, моль/л | Т (HCl), г/мл |
| 10,0 | |||||
| 10,0 | |||||
| 10,0 |
г) объем раствора HCl, пошедший на титрование, находят как среднее арифметическое из 3-х результатов:
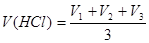
Вычисления нормальности и титра производят с использованием закона эквивалентов:
Сн (HCl) ∙ V(HCl) = Сн (Nа2В4О7) ∙ V(Nа2В4О7)
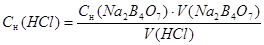


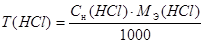
Результаты вычислений заносим в таблицу 1.
Лабораторная работа № 2
Определение массы КОН в исследуемом растворе
Получите у лаборанта исследуемый раствор КОН в мерной колбе на 50 мл. Доведите объем в колбе до метки, приливая дистиллированную воду; перемешайте раствор, закрыв колбу пробкой. Используя аналитическую пипетку, перенесите в каждую колбу для титрования по 10 мл исследуемого раствора и добавьте по 4 капли фенолфталеина.
Титрование исследуемого раствора выполняется рабочим раствором соляной кислоты. Результаты титрования занесите в таблицу 2.
Таблица 2
| № | Объем раствора КОН, мл | Объем раствора НCl, мл | Сн (КОН), моль/л | Т (КОН), г/мл | m (КОН), г |
Массу КОН в исследуемом растворе рассчитывают по формуле:
m (КОН) = Т(КОН) ∙ V (КОН), где V = 50 мл
Выполнить статистическую обработку результатов.
С какой бы тщательностью не проводилось то или иное количественное определение, полученный результат, как правило, всегда несколько отличается от действительного содержания определяемого вещества, т.е. содержит некоторую ошибку.
Статистическая обработка результатов анализа позволяет существенно уменьшить влияние случайных ошибок на результат измерения. Она позволяет представить результаты многих определений в компактной форме и оценить надежность полученных результатов, т.е. степень их соответствия истинному содержанию элемента в образе.
Общепринятой является ниже приведенная методика статистической обработки результатов анализа:
1) расчет среднего арифметического значения определяемой величины (Хi ср.):
Х i ср. = Σ Хi / n,
где n – число измерений;
2) расчет отклонения отдельных измерений от среднего значения (di):
di = Xi – Xi ср.
3) расчет стандартного отклонения или средней квадратической ошибки (s):
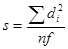
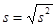 ,
,
где f = n – 1 – число степеней свободы;
4) расчет доверительного интервала результата среднего отклонения (εα), являющегося максимальной случайной ошибкой определения. Сущность этого понятия состоит в том, что при некоторой заданной вероятности и заданном числе степеней свободы f результат отдельного измерения Х попадает в интервал Хср. ± ts.
Доверительный интервал рассчитывается по формуле 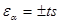 , где t – критерий Стьюдента, значения которого при различных p и f приведены в таблице 3:
, где t – критерий Стьюдента, значения которого при различных p и f приведены в таблице 3:
Таблица 3
| f = n – 1 | p | ||
| 0,9 | 0,95 | 0,99 | |
| 6,31 | 12,71 | 63,66 | |
| 2,92 | 4,30 | 9,92 | |
| 2,35 | 3,18 | 5,84 | |
| 2,13 | 2,78 | 4,60 | |
| 2,01 | 2,57 | 4,03 |
Границы, внутри которых может заключаться каждая определяемая величина Х (границы доверительного интервала), определяются формулой:
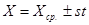
ПРИМЕР: по результатам трех параллельных титрований рассчитать массу вещества в растворе: m1 = 0,0583 г; m2 = 0,0590 г; m3 = 0,0578 г.
1) найдем среднее арифметическое значение искомой величины:
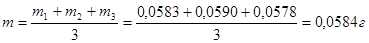
2) рассчитаем отклонения отдельных измерений от среднего значения:
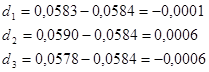
3) вычислим среднюю квадратичную ошибку:
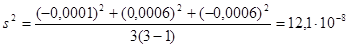
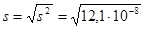
4) найдем доверительный интервал, принимая заданную вероятность равной 0,95; в этом случае при трех параллельных измерениях коэффициент Стьюдента равен 4,30.
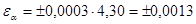
Ответ аналитической задачи должен быть представлен так:
m(в-ва) = 0,0584 ± 0,0013 (г)
Лабораторная работа № 3
Установление титра и нормальности раствора натрия гидроксида
путем титрования рабочим раствором соляной кислоты
В основе определения лежит реакция:
HCl + NаОН → NаCl + Н2O.
Заполняем бюретки 0,1 н. рабочим раствором HCl. Отмеряем в колбы для титрования пипеткой по 10 мл раствора NаОН, нормальная концентрация которого составляет приблизительно 0,1н., и добавляем по 4 капли фенолфталеина. Титрование ведется до того момента, пока раствор в колбе не обесцветится от одной капли титранта и бледно-розовая окраска не появится снова в течение 30 секунд.
Результаты титрования заносятся в таблицу 4.
Таблица 4
Результаты титрования раствора NаОН
стандартным раствором HCl
| № | Объем раствора NаОН, мл | Объем раствора HCl, мл | Средний объем раствора HCl, мл | Сн (NаОН), моль/л | Т (NаОН), г/мл |
| 10,0 | |||||
| 10,0 | |||||
| 10,0 |
Расчеты производят с использованием формул:
Сн(NаОН) ∙ V(NaOH) = Сн(HCl) ∙ V(HCl)
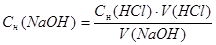
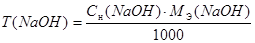
Лабораторная работа № 4
Определение соляной и уксусной кислот
при их совместном присутствии в растворе
Предлагаемый для анализа раствор является моделью желудочного сока. Желудочный сок также является смесью сильной соляной и слабых органических кислот. Соляная и уксусная кислоты могут быть определены раздельно в одном растворе титрованием его щелочью. При титровании будут протекать следующие реакции:
HCl + NaOH → NaCl + H2O
СН3СООН + NaOH → СН3СООNa + Н2О
Н+ + ОН‾→ Н2О
Пока в растворе будет присутствовать соляная кислота, рН раствора будет намного меньше 7 (до 3). Точке эквивалентности первой реакции будет соответствовать значение рН около 3. После нейтрализации соляной кислоты произойдет некоторое скачкообразное увеличение рН, а при дальнейшей нейтрализации щелочью будет наблюдаться второй скачок титрования, отвечающий нейтрализации уксусной кислоты. Точке эквивалентности второй реакции будет соответствовать значение рН около 9. Для определения первой и второй точки эквивалентности можно использовать два индикатора, один из которых должен изменять окраску в сильнокислой среде (тимоловый синий, метиловый желтый), а второй – в щелочной (фенолфталеин). Очень удобен в этом случае для использования в качестве индикатора тимоловый синий, имеющий две области перехода. В сильнокислой среде (рН 1,2) окраска его красная; при повышении рН до 2,8 она переходит в желтую и остается желтой до рН 8. При дальнейшем увеличении рН окраска раствора переходит в голубую.
Получите у лаборанта исследуемый раствор в мерной колбе на 50 мл и доведите объем раствора до метки дистиллированной водой. При помощи аналитической пипетки отберите в каждую колбу для титрования по 10 мл исследуемого раствора и добавьте по 2-3 капли тимолового синего. В качестве титранта используйте рабочий раствор натрия гидроксида. Титруйте исследуемый раствор до того момента, когда от одной капли титранта произойдет изменение окраски индикатора из красной в желтую. Обозначьте этот объем V1(NaOH) и запишите его значение в таблицу. После этого продолжайте титровать раствор до перехода окраски индикатора из желтой в голубую. Запишите показания бюретки, обозначив объем щелочи, пошедший на титрование смеси соляной и уксусной кислот V2(NaOH). Таким образом, выполняются три параллельных титрования.
Таблица 5
Определение масс соляной и уксусной кислот в растворе
| № | V иссл. р-ра, мл | V1 (NaOH), мл | V2 (NaOH), мл | m (HCl), г | m (CH3COOH), г |
Расчеты выполняют при помощи следующих формул:
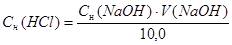
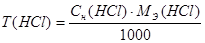
m (HCl) = T (HCl) = 50,0 мл
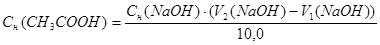
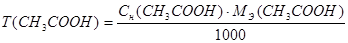
m (CH3COOH) = T(CH3COOH) · 50,0
Выполнить статистическую обработку результатов.
Лабораторная работа № 5
Определение массы натрия гидроксида и натрия карбоната
при их совместном присутствии в растворе
Растворы щелочей почти всегда содержат карбонаты в виде примесей. Эти вещества могут быть определены раздельно в одном растворе титрованием кислотой. Карбонат-ион представляет собой слабое двухкислотное основание и поэтому последовательно присоединяет два иона водорода:
СО32‾ + Н+ = НСО3‾
НСО3‾ + Н+ = Н2СО3
Точке эквивалентности первой реакции соответствует рН 8,34. При этом получается раствор гидрокарбоната. Если в растворе одновременно присутствовала щелочь, то при данном значении рН она также почти полностью вступает в реакцию. Таким образом, титруя исходный раствор кислотой до рН 8,34, одновременно нейтрализуют щелочь, и карбонат превращают в гидрокарбонат. Индикатором в этом титровании может служить фенолфталеин. Дальнейшее добавление кислоты приводит к превращению гидрокарбоната в угольную кислоту. Точке эквивалентности соответствует рН = 4. При этом титрование следует вести с индикатором метиловым оранжевым. На основании изложенного можно заключить, что анализ смеси щелочи и карбоната сводится к последовательному титрованию исследуемого раствора кислотой до обесцвечивания фенолфталеина, а затем до перехода желтой окраски метилового оранжевого в розовую.
Получите у лаборанта исследуемый раствор в мерной колбе на 50 мл и доведите объем до метки дистиллированной водой. При помощи аналитической пипетки отберите по 10 мл раствора в колбы для титрования. Добавьте в каждую колбу по 4 капли фенолфталеина и титруйте исследуемый раствор рабочим раствором соляной кислоты до исчезновения окраски (розовое окрашивание не должно появляться вновь в течение 30 секунд). Запишите первое показание бюретки V1 в таблицу 8. Добавьте в колбу 1-2 капли метилового оранжевого и продолжайте титрование до перехода желтой окраски раствора в розовую. Запишите второе показание бюретки V2. После этого вновь заполните бюретку кислотой и титруйте следующие пробы до получения воспроизводимых результатов. Результаты всех титрований запишите в таблицу 6.
Таблица 6
Определение массы натрия гидроксида и натрия карбоната
| № | Объем исследуемого раствора Na2CO3, мл | Объем титранта HCl, мл | Масса NaOH, г | Масса Na2CO3, г | |
| с фенол- фталеином V1 | с метиловым оранжевым V2 | ||||
| 10,0 | |||||
| 10,0 | |||||
| 10,0 |
Объем раствора кислоты, затраченный на первое титрование (V1), эквивалентен содержащейся и в растворе щелочи и половине всего количества карбоната, т.к. ион СО32‾ при этом присоединяет лишь один ион водорода. Объем кислоты, затраченный на второе титрование (V2–V1), эквивалентен половине имеющегося количества карбоната, т.к. на этой стадии ион СО32‾ присоединяет второй протон. На реакцию с карбонатом на каждой стадии затрачиваются равные объемы кислоты. Поэтому всего на титрование карбоната идет объем кислоты:
V3 = 2(V2–V1)
На нейтрализацию щелочи затрачивается объем кислоты:
V4 = V2–V3.
Рассчитайте V3 и V4 по найденным объемам затраченной кислоты, рассчитайте концентрацию анализируемого раствора по каждому веществу и их массы в растворе.
ФОРМА ОТЧЕТА:
1. Изложить теоретические основы метода.
2. Привести уравнения реакций, лежащих в основе выполненных определений в молекулярной и молекулярно-ионной формах.
3. Заполнить таблицы, приведенные в методических указаниях.
4. Привести расчеты титров и нормальностей рабочих растворов HCl и NaOH.
5. Привести расчеты масс веществ, содержащихся в исследуемых растворах.
6. Выполнить статистическую обработку полученных результатов.
5. ХОД ЗАНЯТИЯ:
Титриметрическим или объемным называют метод количественного анализа, основанный на измерении количества реагента, требующегося для завершения реакции с данным количеством определяемого вещества.
Метод заключается в том, что к раствору определяемого вещества А постепенно прибавляют раствор реактива В известной концентрации. Добавление реактива продолжают до тех пор, пока его количество не станет эквивалентным количеству реагирующего с ним определяемого вещества А.
Количественные определения с помощью объемного метода выполняются очень быстро. Время, требуемое для завершения анализа, измеряется минутами, что позволяет осуществлять экспресс-анализ.
Основоположником титриметрического анализа является французский ученый Ж.Л. Гей-Люссак.
ТИТРОВАНИЕ – это процесс постепенного добавления титранта к анализируемой пробе, продолжающийся до точки эквивалентности.
ТОЧКА ЭКВИВАЛЕНТНОСТИ (момент эквивалентности) – это момент, когда количество вещества эквивалента в добавленном растворе титранта становится равным количеству анализируемого вещества.
ТИТРАНТ – это раствор точно известной концентрации, применяемый для титрования.
Существует два способа приготовления титрантов:
1. Взвешенную на аналитических весах точную навеску вещества растворяют в мерной колбе и доводят объем раствора водой до метки. Зная массу растворенного вещества (m) и объем полученного раствора (V), можно вычислить его титр:
Т = m/V.
Титранты, приготовленные таким образом, называются стандартными растворами и для их получения применимы только те вещества, которые удовлетворяют следующим требованиям:
а) вещество должно быть химически чистым, т.е. должно содержать посторонних примесей не более 0,05-0,1%;
б) состав вещества должен строго соответствовать формуле;
в) вещество должно быть устойчивым при хранении и в твердом виде и в растворе;
2. Если вещества не удовлетворяют этим требованиям, то сначала готовят раствор приблизительно нужной концентрации, а затем устанавливают его точную концентрацию, титруя стандартным раствором. Такие титранты называются стандартизированными или рабочими растворами.
РЕАКЦИИ, ИСПОЛЬЗУЕМЫЕ В ТИТРИМЕТРИЧЕСКОМ АНАЛИЗЕ
К реакциям, используемым в титриметрическом анализе, предъявляют определенные требования:
1) реакция должна быть практически необратимой (К > 108);
2) Реакция должна протекать в строгом соответствии с уравнением химической реакции, без побочных продуктов;
3) реакция должна протекать достаточно быстро;
4) должен существовать надежный способ фиксирования точки эквивалентности. Фиксирование точки эквивалентности может осуществляться химическими (использование индикатора) и физико-химическими методами (потенциометрически, кондуктометрически, фотокалориметрически и т.д.).
КЛАССИФИКАЦИЯ МЕТОДОВ ТИТРИМЕТРИЧЕСКОГО АНАЛИЗА
Разнообразные методы титриметрического анализа можно классифицировать по типу используемых реакций и по способу проведения анализа.
КЛАССИФИКАЦИЯ МЕТОДОВ АНАЛИЗА ПО ТИПУ РЕАКЦИИ
 |
Титриметрический




 анализ
анализ
 |  |  |  |
Кислотно-основное Оксиди- Осадительное Комплексо-
титрование метрия титрование нометрия
 |  |  |  |
Реакции Окислитель- Реакции, сопро- Реакции комплек-
нейтрализации но-восстано- вождающиеся сообразования
вительные образованием
реакции осадка
КЛАССИФИКАЦИЯ МЕТОДОВ АНАЛИЗА ПО СПОСОБУ ТИТРОВАНИЯ
 |
Титриметрический
анализ
 |
Прямое Обратное Косвенное
титрование титрование титрование
 |  |  |
Сущность прямого титрования заключается в постепенном прибавлении титранта непосредственно к раствору анализируемого вещества до достижения точки эквивалентности.
Сущность обратного титрования заключается в добавлении к анализируемому раствору точно известного избытка титранта с последующим определением его остатка, не вступившего в реакцию, с помощью второго титранта.
Сущность косвенного титрования заключается в добавлении к анализируемому веществу избытка реагента, вступающего с ним в реакцию, с последующим определением количества продукта реакции путем титрования.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ: К методу кислотно-основного титрования относят все определения, в основе которых лежит реакция:
Н+ + OH‾ → H2O
По этому методу, пользуясь титрантом какой-либо кислоты, выполняют количественное определение щелочей (ацидиметрия) или, пользуясь титрантом щелочи, количественно определяют кислоты (алкалиметрия). При помощи этого метода проводят ряд других определений, например, определения некоторых солей, имеющих подобно Na2CO3 и Na2B4O7, сильнощелочную реакцию вследствие гидролиза и потому титрующихся кислотами. Кислотно-основное титрование позволяет решать многие задачи, возникающие при клиническом анализе биологических жидкостей, как при постановке диагноза, так и при лечении больных. Определение кислотности желудочного сока, буферной емкости крови и спинномозговой жидкости – примеры использования кислотно-основного титрования в клинической практике. Кроме того, при помощи метода нейтрализации можно анализировать лекарственные вещества, устанавливать доброкачественность продуктов питания (например, молока). Большое значение имеет рассматриваемый метод при санитарно-гигиенической оценке объектов окружающей среды. Промышленные стоки могут содержать как кислые, так и щелочные продукты. Закисление или защелачивание природных водоемов и почвы может привести к необратимым последствиям, в связи с чем контроль кислотно-основного баланса чрезвычайно важен.
Основными титрантами в методе нейтрализации являются растворы кислот (HCl или H2SO4) и растворы щелочей (NaOH или KOH).
В качестве стандартных веществ, при установке титров кислот чаще всего применяют декагидрат натрия тетрабората Na2B4O7∙10H2O или декагидрат натрия карбоната. Для установки титра щелочей чаще всего пользуются щавелевой кислотой H2C2O4·2H2O или янтарной кислотой H2C4H4O4.
Реакции между кислотами и основаниями не сопровождаются, как правило, какими-либо внешними эффектами, поэтому для фиксирования точки эквивалентности приходится использовать специальные вещества – индикаторы.
Кислотно-основные индикаторы – слабые кислоты или основания, степень ионизации которых определяется концентрацией катионов водорода в растворе. Для индикатора-кислоты HInd в водном растворе существует равновесие:
HInd ↔ Н+ + Ind‾
Молекулярная HInd и ионная Ind‾-формы индикатора имеют разную окраску. Таким образом, концентрация ионов Н+ влияет на соотношение концентраций HInd и Ind‾, что, в свою очередь, определяет характер или яркость окраски. Индикаторы изменяют свою окраску не скачкообразно, а плавно, т.е. в определенном интервале значений pH, называемом интервалом перехода.
Таблица 7
Кислотно-основные индикаторы
| Название индикатора | Интервал перехода окраски, рН | Окраска | |
| Кислая среда | Щелочная среда | ||
| Метиловый оранжевый | 3,1 – 4,4 | Розовая | Желтая |
| Лакмус | 5,0 – 8,0 | Красная | Синяя |
| Фенолфталеин | 8,0 – 10,0 | Бесцветная | Малиновая |
| Метиловый красный | 4,4 – 6,2 | Красная | Желтая |
| Лакмоид | 4,4 – 6,2 | Красная | Синяя |
| Нейтральный красный | 6,8 – 8,0 | Красная | Желтая |
| Тимоловый синий (два интервала) | 1,2 – 2,8 8,0 – 9,6 | Красная желтая | Желтая синяя |
| Метиловый фиолетовый | 0 – 1,8 | Желтая | Фиолетовая |
В аналитической практике при титровании сильных кислот сильным основанием чаще других применяют метилоранж и фенолфталеин; при титровании слабого основания сильной кислотой – метилоранж; при титровании слабой кислоты сильным основанием – фенолфталеин. При наличии в растворе двух кислот, двух оснований или двух гидролизующихся солей фиксируют две точки эквивалентности при помощи двух индикаторов.
6. вопросы ДЛЯ САМОконтроля знаний:
1. Методы количественного анализа: весовой (гравиметрический); объемный (титриметрический).
2. Основные понятия объемного анализа: титрование, титрант, точка эквивалентности. Закон эквивалентов.
3. Требование к реакциям, применяемым в титриметрическом анализе.
4. Классификация методов титриметрического анализа.
5. Метод кислотно-основного титрования (метод нейтрализации).
6. Какие факторы определяют выбор индикатора при кислотно-основном титровании?
7. Какие стандартные растворы применяются при кислотно-основном титровании?
Расчетные задачи:
1. Какую массу дигидрата щавелевой кислоты Н2C2О4·2Н2О нужно взять, чтобы на ее титрование расходовалось 20 мл 0,1 М раствора NaOH (М(Н2C2О4∙2Н2О) = 126 г/моль)?
Ответ: 0,1260 г
2. 9,7770 г концентрированного раствора HNO3 разбавили водой до 1 л в мерной колбе. На титрование 25,00 мл полученного раствора израсходовано 23,40 мл 0,1040 М раствора NaOH. Определите массовую долю азотной кислоты в ее концентрированном растворе.
Ответ: 62,73%
3. На титрование 20,00 мл раствора HCl с титром, равным 0,001825 г/мл, израсходовано 23,04 мл раствора NaOH. Вычислите нормальную концентрацию эквивалента и титр раствора NaOH.
Ответ: 0,04 моль/л
0,001600 г/мл
4. На титрование 0,2860 г Na2CO3∙10H2O в присутствии метилового оранжевого израсходовано 24,10 мл раствора HCl. Рассчитайте молярную концентрацию и титр раствора HCl.
Ответ: 0,08299 моль/л
0,003029 г/мл
5. Определите молярную концентрацию раствора КОН, если на титрование 15,00 мл его израсходовано 18,70 мл раствора HCl с титром, равным 0,002864 г/мл.
ОТВЕТ: СM(КОН) = 0,09782 моль/л
6. Навеску технического натрия карбоната массой 1,60 г растворили в мерной колбе вместимостью 250 мл. На титрование 10,0 мл полученного раствора в присутствии метилового оранжевого затрачено 12,0 мл раствора соляной кислоты с молярной концентрацией 0,1000 моль/л. Рассчитайте массовую долю основного вещества в навеске.
ОТВЕТ: 99,36 %
7. Для определения содержания бария гидроксида анализируемый раствор перенесли в мерную колбу вместимостью 100 мл и довели дистиллированной водой до метки. На титрование 5 мл полученного раствора было затрачено 14,33 мл раствора HCl с молярной концентрацией 0,105 моль/л. Вычислите массу бария гидроксида в анализируемом растворе.
ОТВЕТ: 2,574 г
8. Сколько граммов H3PO4 содержится в растворе, если на титрование его с фенолфталеином затрачено 25,50 мл 0,2000 н. раствора NaOH (при условии полной нейтрализации)?
ОТВЕТ: 0,167 г
9. Азот из навески 0,8880 г органического вещества действием концентрированной Н2SO4 переведен в (NH4)2SО4, при кипячении которого с концентрированной щелочью получен аммиак. Выделяющийся NH3 поглощен 0,1200 н. раствором Н2SO4, которого было взято 50,0 мл. Сколько процентов азота содержит органическое вещество, если на титрование избытка Н2SO4 израсходовано 12,00 мл 0,09800 н. раствора NaOH?
ОТВЕТ: 7,61%
10. Для определения общей кислотности желудочного сока 5 мл сока оттитровали раствором NaOH с концентрацией 0,095 моль/л в присутствии фенолфталеина. На титрование израсходовано 2,8 мл раствора щелочи. Рассчитайте кислотность анализируемого сока, ммоль/л.
ОТВЕТ: 53,2 ммоль/л
11. Рассчитайте содержание соляной кислоты и общую кислотность (в ммоль/л) желудочного сока, если на титрование 10 мл сока с метиловым оранжевым израсходовано 3,1 мл раствора щелочи с концентрацией 0,098 моль/л, а с фенолфталеином – 6,0 мл щелочи.
ОТВЕТ: 0,03038 моль/л,
0,05880 моль/л
12. Чему равна карбонатная жесткость воды, если на титрование 100 мл ее израсходовано 5,00 мл 0,09000 н. раствора НСl?
ОТВЕТ: 4,5 мг-экв/л.
13. Сколько граммов КОН и К2СО3 содержит навеска препарата технического едкого кали, если на титрование ее раствора в произвольном объеме воды с фенолфталеином израсходовано 22,40 мл, а с метиловым оранжевым 25,80 мл 0,09500 н раствора НСl?
ОТВЕТ: 0,0446 г К2СО3,
0,1011 г КОН
14. При титровании 25,00 мл раствора, содержащего смесь Na2СО3 и NaHСО3 c фенолфталеином, израсходовано 9,46 мл, а с метиловым оранжевым 24,86 мл 0,1200 н. раствора H2SO4. Сколько граммов Na2СО3 и NaHCO3 содержится в 250 мл раствора?
ОТВЕТ: 1,203 г Na2СО3,
0,599 г NaHCO3
|
|
|
Дата добавления: 2015-06-04; Просмотров: 2875; Нарушение авторских прав?; Мы поможем в написании вашей работы!