
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кальций
|
|
|
|
Барий
Реакции обнаружения катионов второй группы
Общие реакции катионов II группы
Лабораторная работа №2
Техника безопасности
Окраска соединений
Комплексообразование
Гидролиз солей
Свойства гидроксидов
Степень окисления
Общая характеристика катионов второй группы
Вторая группа катионов
Во вторую (сульфатную) группу входят катионы Ca2+, Sr2+, Ba2+. При действии группового реагента 2н серной кислоты образуются белые осадки СаSO4, SrSO4, BaSO4 различной растворимости. Произведения растворимости их следующие: ПРСаSO4=2,4*10-5, ПРSrSO4=3,2*10-7, ПРBaSO4=2,1*10-10. Наиболее растворимый - сульфат кальция в ходе анализа осаждается серной кислотой не- полностью и попадает в другие группы. Эти сульфаты не растворяются в кислотах. В воде труднорастворимы и карбонаты этих ионов (ПРСаСO3=4,8*10-9, ПРSrСO3=1,6*10-9, ПРBaСO3=8*10-9), однако они растворимы даже в уксусной кислоте.
Все металлы, образующие катионы этой группы, являются S-элементами второй группы ПСМ (ns2) и образуют соединения со степенью окисления +2. В окислительно-восстановительных процессах не участвуют.
Гидроксиды этих элементов Ca(OH)2, Sr(OH)2, Ba(OH)2 являются сильными основаниями, в воде растворимость их увеличивается от Ca(OH)2 к Ba(OH)2. Получить их можно непосредственным растворением в воде оксидов или самих металлов.
Поскольку основные свойства здесь выражены сильно, соли металлов II группы, образованные сильными кислотами, не подвергаются гидролизу и имеют в растворе реакцию, близкую к нейтральной (рН»6). Следовательно, гидролизу могут подвергаться только растворы солей слабых кислот, которые имеют щелочную реакцию.
Катионы Ca2+, Sr2+, Ba2+ как типичные S-элементы не образуют устойчивых комплексов.
Ионы Ca2+, Sr2+, Ba2+ имеют законченные 8-электронные оболочки. В водных растворах эти ионы бесцветны.
При проведении анализа второй группы катионов соблюдать общие правила по технике безопасности в химических лабораториях. Растворимые соли бария и стронция ядовиты.
«Изучение свойств катионов II аналитической группы и анализ их смеси»
Цель работы: изучение свойств солей, гидроксидов ионов Ca2+, Sr2+, Ba2+; знакомство с методами разделения и обнаружения.
Проделать реакции катионов с веществами, представленными в табл. 3. Записать уравнения реакций.
Таблица 3
| Реактив | Катионы | ||
| Ca2+ | Sr2+ | Ba2+ | |
| 1. H2SO4 | CaSO4¯ белый, выпадает не сразу | SrSO4¯ белый | BaSO4¯ белый |
| 2. Na2CO3 | CaCO3¯ белый | SrCO3¯ белый | BaCO3¯ белый |
| 3. K2CrO4 (pH=7) | - | SrCrO4¯ жёлтый | BaCrO4¯ жёлтый |
| 4. K2Cr2O7+ CH3COONa | - | - | BaCrO4¯ жёлтый |
К 2-3 каплям растворимой соли бария прилить 3-4 капли раствора K2Cr2O7. Реакцию проводят в присутствии ацетата натрияCH3COONa. Эта реакция используется не только для открытия ионов бария, но и для отделения его от ионов кальция и стронция.
2BaCl2 + K2Cr2O7 + H2O «2BaCrO4¯ + 2KCl + 2HCl
жёлтый
2Ba2+ + Cr2O72- + H2O «2BaCrO4¯ + 2H+
Бихромат калия образует с ионом Ba2+ жёлтый осадок BaCrO4, а не BaCr2O7, как можно было бы ожидать. Растворимость хромата бария меньше, чем бихромата бария (ПР BaCrO4=1,8*10-14, ПР BaCr2O7=1,2*10-9), поэтому концентрация ионов CrO42-, имеющихся в растворе данного равновесия:
Cr2O72- + H2O «2Cr2O42- + 2H+,
достаточна, чтобы образовался именно BaCrO4.
Полнее реакция осаждения хромата бария идёт в присутствии избытка ацетата натрия, понижающего концентрацию образующих катионов водорода с образованием слабой кислоты СН3СООН:
СН3СОО- + Н+ ® СН3СООН
Избыток СН3СООNа создаёт ацетатную буферную смесь, поддерживающую значение рН»5.
Нейтрализовать ионы водорода щёлочью нельзя, так как при больших значениях рН выпадает жёлтый осадок хромата стронция и реакция становится неспецифичной.
Микрокристаллоскопическая реакция. С помощью этой реакции можно открыть ионы кальция в присутствии небольших количеств других ионов. 1 каплю раствора соли кальция нанести на предметное стекло и добавить 1 каплю H2SO4 2н и слегка подсушить на воздухе так, чтобы подсох только край капли. Образующиеся красталлы гипса CaSO4*2H2O имеют игольчатую форму (напоминающую снежинки) при рассмотрении под микроскопом (рис. 1). Открытию иона кальция мешает большая концентрация ионов Ba2+.
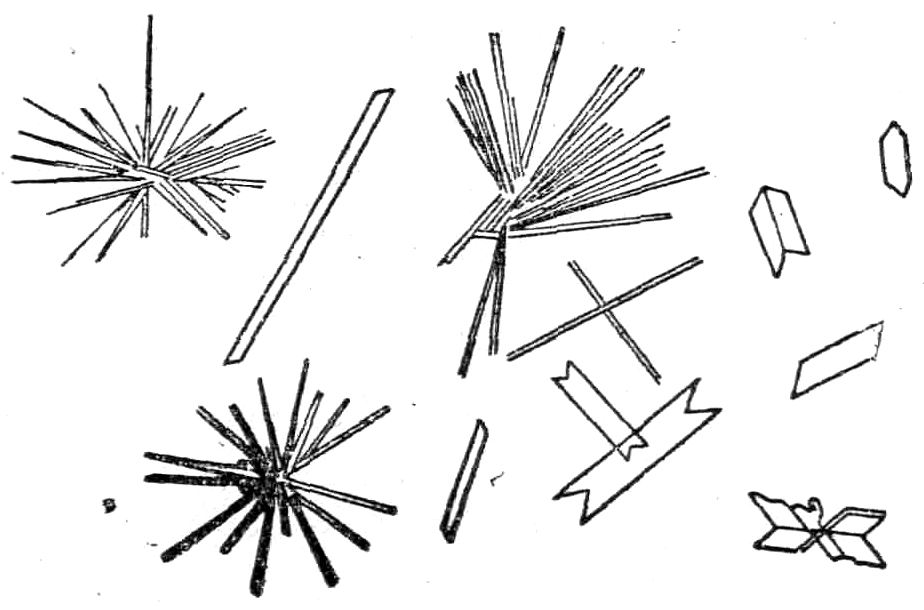
Рис. 1. Кристаллы сульфата кальция
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 1712; Нарушение авторских прав?; Мы поможем в написании вашей работы!