
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакции, которые сопровождаются внешним аналитическим эффектом
|
|
|
|
1. Образование или растворение осадка
AgNO3 + HCl 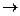 AgCl
AgCl 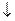 + HNO3 (уравнение реакции обмена)
+ HNO3 (уравнение реакции обмена)
AgCl 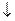 + 2 NH3 H2O
+ 2 NH3 H2O 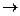 [Ag(NH3)2]Cl + 2 H2O (уравнение реакции
[Ag(NH3)2]Cl + 2 H2O (уравнение реакции
белый концентр. бесцветный комплексообразования)
осадок раствор раствор
2. Изменение цвета раствора или образование окрашенного соединения:
FeCl3 + 3 NH4SCN 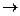 Fe (SCN)3 + 3 NH4Cl (уравнение реакции обмена)
Fe (SCN)3 + 3 NH4Cl (уравнение реакции обмена)
желтый бесцветный кроваво-красный
Реакция комплексообразования:
CuSO4 + 4 NH3H2O = [Cu (NH3)4]SO4 + 4 H2O
голубой раствор темно-синий раствор
сульфат тетраамминомеди (II)
3. Выделение газа:
Na2CO3 + 2 HCl = 2 NaCl + H2CO3; H2CO3 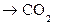
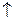 + H2O
+ H2O
4. Частный случай реакции обмена - реакция гидролиза соли
SbCl3 + HOH = SbOCl 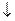 + 2 HCl
+ 2 HCl
белый осадок
оксохлорид сурьмы
5. Реакции окисления - восстановления:
2 Mn (NO3)2 + 5 NaBiO3 + 4 HNO3 = 2 NaMnO4 + 5 (BiO) NO3 + 3 NaNO3 + 2 H2O
бесцветный р-р кристаллы розовый раствор
восстановитель окислитель
ТЕРМИНЫ И ПОНЯТИЯ В АНАЛИТИЧЕСКОЙ ХИМИИ
1. ЧАСТНЫЕ (ХАРАКТЕРНЫЕ) АНАЛИТИЧЕСКИЕ РЕАКЦИИ, при которых РАЗЛИЧНЫЕ РЕАГЕНТЫ дают характерные аналитические эффекты с ОДНИМ ионом.
Pb2+ + 2 KI = 2 K + + PbI2 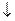 (желтый осадок)
(желтый осадок)
Pb2+ + K2CrO4 = 2 K+ + PbCrO4 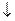 (желтый осадок)
(желтый осадок)
Pb2+ + 2 HCl = 2 H+ + PbCl2 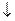 (белый осадок)
(белый осадок)
Pb2+ + H2SO4 = 2 H+ + PbSO4 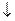 (белый осадок)
(белый осадок)
2. ОБЩИЕ (ГРУППОВЫЕ) РЕАКЦИИ. ОБЩИЙ (ГРУППОВОЙ) РЕАГЕНТ.
ОДИН РЕАГЕНТ образует характерный аналитический эффект (образование осадков или образование растворов) с РАЗНЫМИ ИОНАМИ.
Групповыми реагентами могут быть
КИСЛОТЫ - HCl, H2SO4, H2S
ОСНОВАНИЯ - NaOH (KOH), NH4OH
СОЛИ - BaCl2, AgNO3, (NH4)2CO3, Na3PO4.
Групповой реагент дает название методу анализа.
Групповой реагент на II аналитическую группу катионов - это раствор 2 моль/ л HCl:
Pb2+ + 2 HCl = 2 H+ + PbCl2  (белый осадок)
(белый осадок)
Ag+ + HCl = H+ + AgCl  (белый осадок)
(белый осадок)
Групповым реагентом на I аналитическую группу анионов служит раствор соли BaCl2:
SO42- + BaCl2 = 2 Cl- + BaSO4  (белый осадок)
(белый осадок)
СО32- + BaCl2 = 2 Cl- + BaCO3  (белый осадок)
(белый осадок)
SiO32- + BaCl2 = 2 Cl- + BaSiO3 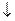 (белый осадок)
(белый осадок)
2 PO43- + 3 BaCl2 = 6 Cl- + Ba3(PO4)2 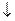 (белый осадок)
(белый осадок)
3. СПЕЦИФИЧЕСКИЙ РЕАГЕНТ, которым можно открыть данный ион в присутствии других ионов.
Крахмал + свободный йод I2 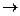 появляется окраска темно-синего цвета.
появляется окраска темно-синего цвета.
Fe3+ + 3 SCN- = Fe (SCN)3 продукт реакции кроваво - красного цвета.
Специфичность, селективность, избирательность - одинаковые понятия.
4. ОТКРЫТИЕ, обнаружение, распознавание, идентификация, определение.
5. РАЗДЕЛЕНИЕ - отделение одного иона от другого или других ионов разными способами, приемами, методами.
6. ПРЕДЕЛ ОБНАРУЖЕНИЯ (чувствительность) - это минимальная концентрация вещества, которую можно определить данной реакцией или данным реагентом. Предел обнаружения или открываемый минимум может выражаться числом атомов, молекул, или других частиц, а также массой в микрограммах (мкг), (1 мкг = 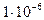 г.).
г.).
Предел обнаружения в цветных реакциях составляет до 10-11 г.
Например, открываемый минимум Ca2+ составляет 0,1 мг (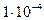 г.) реакцией
г.) реакцией
CaCl2 + H2SO4 + 2 H2O = 2 HCl + CaSO4 2 H2O
гипс, игольчатые кристаллы
Предельное разбавление характеризует наименьшую концентрацию вещества (иона), при которой обнаружение его посредством данной реакции возможно. Предельное разбавление выражают отношением 1: g (где g - весовое количество растворителя на 1 весовую часть обнаруживаемого иона). Обычно в качественном анализе применяют лишь те реакции, открываемый минимум которых не больше 50 мкг, а предельное разбавление 1: 1000.
Между открываемым минимумом (мкг) и предельным разбавлением существует соотношение m = 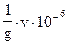 , где V - объем раствора в мл, который берут для выполнения реакции. 1 капля раствора = 0,05 мл.
, где V - объем раствора в мл, который берут для выполнения реакции. 1 капля раствора = 0,05 мл.
Например. При предельном разбавлении 1: 60000 (или 6 х 104) и открываемом минимуме в 4 мкг, надо взять не менее 6х104х4х10-6 = 24х10-2 = 0,24 мл.
ЧУВСТВИТЕЛЬНОСТЬ РЕАКЦИИ зависит:
n от толщины слоя раствора (в малом слое можно не обнаружить открываемый ион, а в большом слое можно увидеть помутнение, как признак присутствия иона);
n от продолжительности реакции (увеличение продолжительности реакции увеличивает чувствительность реакции);
n добавление органического растворителя повышает чувствительность реакции:
добавление спирта понижает растворимость образовавшегося осадка неорганической соли;
взбалтывание (перемешивание) водной реакционной смеси с органической жидкостью, не смешивающейся с водой. Продукт реакции собирается на границе органической и водной фаз и становится хорошо различим. Например,
Co2+ + 4 SCN- = [ Co (SCN)4 ]2-
тетратиоцианокобальтат (II) анион
При добавлении к образовавшемуся комплексному иону ацетона наблюдается голубого цвета раствор, при этом уменьшается диссоциация комплексного аниона. Если добавить изоамиловый спирт (или смесь изоамилового спирта с эфиром), не смешивающийся с водой, то происходит извлечение (экстракция) комплексного иона в слой органического растворителя и синяя его окраска становится более интенсивной. Процессы экстракции играют большую роль в аналитической химии, так как позволяют повысить чувствительность и избирательность метода анализа.
7. МАСКИРОВАНИЕ - это прием для связывания мешающего иона в ходе анализа.
“Маскирующие вещества” связывают мешающие ионы в достаточно прочные комплексы и тем самым сильно понижают их концентрацию в растворе. В качестве маскирующих веществ применяются неорганические вещества: цианиды СN-, тиоцианиды (роданиды)
SCN-, фториды F-, фосфаты HPO42-, PO43-, оксалаты C2O42- щелочных металлов и аммония; органические - тиомочевина, лимонная кислота, щавелевая кислота, винная кислота, комплексоны.
Например. Fe3+ мешает открытию Co2+, так как они открываются одним специфическим реагентом SCN-, но кроваво-красный цвет Fe (SCN)3 закрывает голубой цвет соединения кобальта [Co(SCN)4]2-. Поэтому, если открыто Fe3+, то перед открытием Co2+, следует применить маскирование Fe3+, используя маскирующие вещество фторид аммония NH4F
в виде сухой соли. Фторид ион с ионом Fe3+ образует бесцветный комплексный ион
[FeF6]3- и затем можно открывать в растворе катион кобальта Co2+ c SCN-, добавив к раствору смесь эфира с изоамиловым спиртом для повышения чувствительности реакции и усиления цвета раствора. Если присутствует Co2+, то наблюдается синее окрашивание органического слоя, в который экстрагируется комплексный ион [Co(SCN)4]2-.
Например. Открытие Zn2+ проводят при рН ~ 7 органическим реагентом дитизоном. Образуется продукт реакции красноватого (розового) цвета. Подобный аналитический эффект с дитизоном образуют катионы Ag+, Cu2+, Pb2+. Чтобы открыть катион Zn2+ в присутствии катионов Ag+, Cu2+, Pb2+, используют прием маскирования этих катионов с помощью тиосульфата натрия Na2S2O3. Катионы Ag+, Cu2+, Pb2+ образуют с Na2S2O3 устойчивые бесцветные комплексные анионы:
Ag+ + 2 S2O32- = [Ag(S2O3)2]3- Кнест. = 3,4 x 10-14
Cu2+ + 2 S2O32- = [Cu(S2O3)2]2- Кнест. = 5,1 x 10-13
Pb2+ + 2 S2O32- = [Pb(S2O3)2]2- Кнест. = 7,7 x 10-6
Pb2+ + 3 S2O32- = [Pb(S2O3)3]4- Кнест. = 4,5 x 10-7
8. УСЛОВИЯ ПРОВЕДЕНИЯ РЕАКЦИЙ
8.1. рН (среда выполнения реакции)
Проводя ту или иную реакцию, необходимо создавать определенные условия, зависящие от свойств реагентов и образующихся продуктов реакции, так как иначе результат будет неправильным или не получится.
Например, осадки, растворимые в избытке щелочи, не выпадут в щелочной среде. Это относится к соединениям с амфотерными свойствами. Осадки, растворимые в кислотах, не выпадут в кислой среде. Поэтому одним из важнейших условий выполнения реакции является проверка и создание нужной рН.
Щелочная среда рН 9 и более создается добавлением 2 моль/л раствора NaOH (KOH), NH4OH.
Кислая среда рН 3 и меньше создаются сильными кислотами 2 моль/л HCl, 1 моль/л H2SO4. Слабокислая среда рН 4 - 5 создается 2 моль/л CH3COOH.
Нейтральная среда создается последовательным добавлением кислоты и основания или наоборот, обычно слабыми уксусной кислотой и раствором аммиака.
Широко применяют в анализе БУФЕРНЫЕ РАСТВОРЫ. Их применяют, когда при выполнении опыта рН не должно изменяться, а быть постоянным, что поддерживается с помощью буферной смеси. Буферные растворы (или буферные смеси) - это смеси слабых кислот и их солей, слабых оснований и их солей, средних и кислых солей.
Например.
CH3COOH и CH3COONa pH 4,7 ацетатный буфер
слабая кислота и ее соль
NH4OH и NH4Cl pH 9 аммонийный (аммиачный) буфер
слабое основание и его соль
NaHCO3 + Na2CO3 pH 8
кислая соль средняя соль
роль слабой ее соль
кислоты
NaH2PO4 + Na2HPO4 pH 6 - 8 фосфатный буфер
кислые соли
Рассмотрим значение рН, необходимое для осаждения Ba2+ хроматом (или дихроматом).
Хроматы - это соли хромовой кислоты H2CrO4, дихроматы - это соли дихромовой кислоты
H2Cr2O7. Обе кислоты по первой стадии диссоциируют полностью, а по второй - частично. Константы диссоциации по второй стадии равны:
K (HCrO4-) = 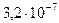 . K (HCr2O7-) =
. K (HCr2O7-) = 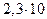 -2
-2
Независимо от взятого реагента - хромата или дихромата - в водном растворе присутствуют те и другие ионы:
2 HCrO4- + H+ = HCr2O7- + H2O
Запишем выражение константы равновесия для этого уравнения и вычислим ее значение:
K = 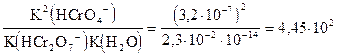
С повышением кислотности раствора концентрация дихромата увеличивается, а концентрация хромата уменьшается. В нейтральных и щелочных растворах присутствует преимущественно HCrO4- или СrO42-. Поэтому хромат бария BaCrO4 осаждается в нейтральной, щелочной или слабокислой среде. Кислотность (или значение рН), при которой будет полное осаждение хромата бария можно вычислить из равновесия реакции:
2 BaCrO4 + 3 H+ 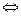 2 Ba2+ + HCr2O7- + H2O
2 Ba2+ + HCr2O7- + H2O
Запишем выражение константы равновесия для данного уравнения и вычислим ее:
K= 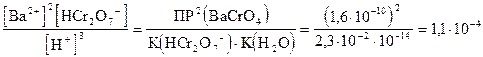
Примем остаточную концентрацию катиона бария [Ba2+] = 10-5 моль/л, а [HCr2O7-]=1моль/л.
Возьмем из справочника значение произведения растворимости хромата бария
ПР (BaCrO4) = 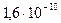 .
.
Выведим концентрацию ионов водорода из выражения константы равновесия и вычислим ее:
[H+] = 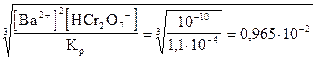
Отсюда, полное осаждение хромата бария будет при рН > 2.
8.2. ТЕМПЕРАТУРА
Важным условием проведения реакции является температура раствора. Некоторые реакции идут только при нагревании.
Например. Открытие или обнаружение Cr3+ проводят только при нагревании на водяной бане до образования хромата - раствора желтого цвета по реакции
2 Cr3+ + 3 H2O2 + 10 OH- = 2 CrO42- + 8 H2O
Осадки, растворимость которых сильно увеличивается при нагревании, не следует получать из нагретых растворов.
Некоторые реакции проводят при охлаждении.
Например. Определение катиона Na+ реагентом гексагидроксостибатом (V) калия K[Sb(OH)6] проводят при охлаждении пробирки с реакционной смесью под струей холодной водопроводной воды из под крана. Ионно-молекулярное уравнение определения:
Na+ + [Sb(OH)6]- = Na[Sb(OH)6] 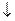
Образуется белый мелкокристаллический осадок гексагидроксостибата (V) натрия.
Большинство реакций проходит при стандартной температуре.
8.3. ДОСТАТОЧНАЯ КОНЦЕНТРАЦИЯ ИОНОВ В РАСТВОРЕ
При очень малых концентрациях иона в растворе реакция может не получиться. При этом учитывают открываемый минимум и предельное разбавление. При получении осадка следует помнить условие образования осадка: произведение концентрации ионов (в степени их стехиометрических коэффициентов) должно превышать величину произведения растворимости данного малорастворимого вещества.
Например. При открытии катиона свинца Pb2+ действием реагента 2 моль/л HCl можно не увидеть белый осадок хлорида свинца PbCl2:
Pb2+ + 2 Cl- = PbCl2 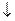 ,
,
если [Pb2+] [Cl-]2 < ПР (PbCl2). В этом случае следует повторить открытие Pb2+ c реагентом KI.
ПР (PbCl2) = 1,6 x 10-5
ПР (PbI2) = 1,9 x 10-9
Из сравнения величин произведений растворимости осадков следует, что йодид свинца менее растворим и для образования этого осадка достаточно меньшей концентрации катионов свинца и скорее будет достигнуто соотношение [Pb2+] [I-]2 > ПР (PbI2).
ОПЕРАЦИИ ВЫПОЛНЕНИЯ АНАЛИТИЧЕСКИХ РЕАКЦИЙ
1. Осаждение. К определяемому иону добавляют реагент (осадитель) в небольшом избытке. Идет процесс образования осадка и выпадение его в виде твердой фазы.
2. Центрифугирование. Отделение осадка от раствора (твердой фазы от жидкой фазы).
Центрифугирование проводят в центрифужных пробирках в центрифуге. Раствор над осадком называют центрифугатом и после центрифугирования его сливают с осадка.
3. Промывание осадка. К осадку добавляют 2-3 мл дистиллированной воды, перемеши-
вают стеклянной палочкой, центрифугируют и промывную жидкость сливают с осадка.
4. Растворение осадка. В зависимости от природы и типа осадка используют различные
растворители (воду, кислоты, смеси кислот, щелочи, раствор аммиака или органические
растворители).
5. Нагревание. В зависимости от цели нагревание проводят на водяной бане, на
асбестовой сетке на газовой горелке.
6. Упаривание (выпаривание) растворов ( для концентрирования раствора, для образования кристаллов) проводят на водяной бане, на песчанной бане, на асбестовой сетке на газовой горелке.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 1905; Нарушение авторских прав?; Мы поможем в написании вашей работы!