
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основания
|
|
|
|
СОЛЯНАЯ КИСЛОТА И ХЛОРОВОДОРОД
Получают хлороводород таким образом:
1) слабое нагревание
NaCl + H  SO
SO  = NaHSO
= NaHSO  + HCl
+ HCl 
2) сильное нагревание
2NaCl + H  SO
SO  = Na
= Na  SO
SO  + 2HCl
+ 2HCl 
HCl – бесцветный газ с резким запахом, немного тяжелее воздуха, во влажном воздухе дымит. При 0 градусов в одном объеме воды растворяется 500 объемов хлороводорода.
Химические свойства соляной кислоты:
1ое свойство: изменяет окраску индикаторов: лакмус в соляной кислоте краснеет, метилоранж – розовеет, фенолфталеин остается бесцветным.
2ое свойство: взаимодействует с металлами:
Mg + 2HCl = MgCl  + H
+ H 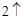
3е свойство: взаимодействует с основными оксиды:
Fe  O
O  + 6HCl = 2FeCl
+ 6HCl = 2FeCl  + 3H
+ 3H  O
O
Примечание: HCl + AgNO  = AgCl
= AgCl 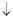 +HNO
+HNO 
CaO + H  O = Ca(OH)
O = Ca(OH) 
В этой реакции образовался гидрат оксида кальция, или гидроксид кальция.
Основания состоят из металла и одновалентных гидроксильных
групп (OH), число которых соответсвует валентности металла.
Основания:
NaOH – гидроксид натрия
Mg(OH)  - гидроксид магния
- гидроксид магния
Ba(OH)  - гидроксид бария.
- гидроксид бария.
Fe(OH)  - гидроксид железа (II)
- гидроксид железа (II)
Fe(OH)  - гидроксид железа (III)
- гидроксид железа (III)
Все основания имеют немолекулярное строение.
По растворимости в воде разделяются на:
А) растворимые (щелочи)
Пример: гидроксид натрия NaOH, гидроксид калия KOH, гидроксид бария Ba(OH)  и т.п.
и т.п.
Б) нерастворимые
Пример: гидроксид меди (II) Cu(OH)  , гидроксид железа (III)
, гидроксид железа (III)
Fe(OH)  и т.п.
и т.п.
Растворимые основания можно получить при взаимодействии активных металлов с водой и оксидов активных металлов с водой, которые называются основными оксидами:
2Na + 2H  O = 2NaOH + H
O = 2NaOH + H 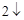
BaO + H  0 = Ba(OH)
0 = Ba(OH) 
Вывод: все основания реагируют с кислотами, образуя соль и воду.
Например:
NaOH + HNO  = NaNO
= NaNO  + H
+ H  O
O
Cu(OH)  + 2HCl = CuCl
+ 2HCl = CuCl  + 2H
+ 2H  O
O
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 271; Нарушение авторских прав?; Мы поможем в написании вашей работы!