
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы. Их характеристики. Законы Рауля и Генри. Диаметры растворимости
|
|
|
|
Определение. Жидкими растворами называется молекулярная смесь двух или нескольких веществ, находящихся в жидком состоянии. Если одно из веществ присутствует в растворе в значительно большем количестве, чем другие, то оно называется растворителем, а другие — растворенными веществами. Растворы, состоящие из двух веществ, называются бинарными.
Количественные характеристики. Относительная концентрация веществ в растворе: 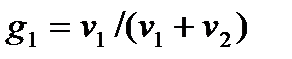 ,
, 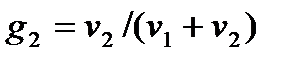 ,
, 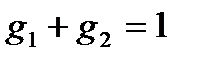 .
.
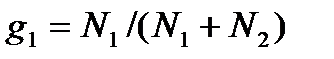 ,
, 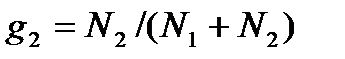 ,
, 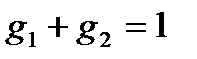 .
.
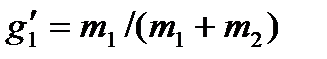 ,
, 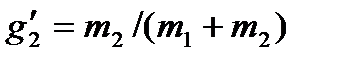 ,
, 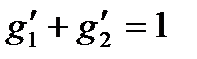 ,
,
где m1 и m2— массы компонент, входящих в раствор.
Растворимость. Раствор может быть образован как в результате растворения в жидкости твердых веществ, так и смешением жидкостей. В некоторых ситуациях существует предел концентрации одного из веществ. При дальнейшем добавлении этого вещества в раствор оно уже не растворяется. Например, нельзя растворить в данном количестве воды сколь угодно большое количество сахара. В этом случае максимальная равновесная концентрация называется растворимостью. Она зависит от давления и температуры.
Теплота растворения. Механизм растворения сводится к разрыву связей между молекулами каждого из исходных веществ и образованию новых связей между молекулами веществ, находящихся в растворе. Во многих случаях при растворении молекулы вещества распадаются на свои составные части — ионы (у солей, щелочей и т. д.).
После разъединения молекул растворяемого вещества силы притяжения между молекулами растворенного вещества и растворителя могут быть столь значительными, что приводят к образованию комплексов молекул. При этом за счет работы сил притяжения внутренняя энергия увеличивается и происходит нагревание. Если это нагревание больше, чем охлаждение при разъединении молекул растворяемого вещества, то чистый итог процесса растворения сводится к нагреванию при растворении. Выделяющаяся при этом теплота также называется теплотой растворения. К таким случаям относится, например, растворение кислот в воде.
Идеальные растворы. Это такие растворы, у которых теплота растворения равна нулю.
Закон Рауля. Из условия динамического равновесия на границе между насыщенным паром и раствором следует, что давление насыщенных паров растворителя должно быть меньше их давления над чистым растворителем во столько же раз, во сколько плотность молекул растворителя меньше, чем когда он является чистым, без растворенного в нем вещества. Иначе говоря, давление насыщенных паров уменьшается во столько раз, во сколько уменьшается концентрация растворителя:
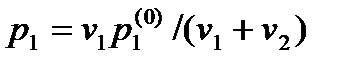 ,
,
где 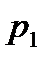 — давление насыщенных паров над раствором,
— давление насыщенных паров над раствором, 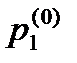 — давление насыщенных паров над чистым растворителем. Аналогично для давления
— давление насыщенных паров над чистым растворителем. Аналогично для давления 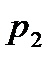 насыщенных паров растворенного вещества получаем:
насыщенных паров растворенного вещества получаем:
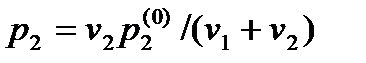
Формулы выражают закон Рауля для идеальных растворов. Однако он достаточно хорошо выполняется также для всех слабых растворов (не обязательно идеальных), если речь идет о насыщенных парах растворителя. Это обусловлено незначительностью концентрации растворенного вещества, которая не способна сколько-нибудь заметно изменить в целом взаимодействие между молекулами растворителя.
У неидеальных растворов давление насыщенных паров меняется не только за счет изменения плотности молекул у поверхности, но и за счет изменения сил взаимодействия между молекулами растворителя и растворенного вещества в растворе. Это может вызвать отклонение от предсказаний по закону Рауля в любую сторону. Столь же простого закона, как закон Рауля, для неидеальных растворов не существует.
Закон Генри. Закон Рауля (37.4) можно прочитать справа налево. Тогда он характеризует концентрацию вещества в растворе, если над раствором поддерживается давление р2 насыщенных паров этого вещества:
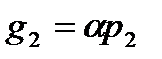
где 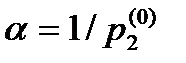
Концентрация газа, растворенного в жидкости, пропорциональна давлению газа над поверхностью жидкости. Поэтому, в частности, для получения газированной воды углекислый газ к ней подводится под большим давлением.
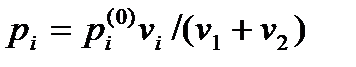
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 1293; Нарушение авторских прав?; Мы поможем в написании вашей работы!