
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Введение
|
|
|
|
СПЕКТР ПОГЛОЩЕНИЯ МОЛЕКУЛ ЙОДА
ЭТАЛОНЫ ОТВЕТОВ
| 1 – 1, 2 | 6 – 3 | 11 – 3 | 16 – 1, 3, 4, 5 |
| 2 – 1, 3, 4, 5 | 7 – 1 | 12 – 1 | 17 – 2 |
| 3 – 2, 3, 4 | 8 – 2 | 13 – 4 | 18 – 1, 2, 4 |
| 4 – 4 | 9 – 4 | 14 – 1, 3, 4 | 19 – 1, 2, 4, 5 |
| 5 – 1, 3, 4, 5 | 10 – 2 | 15 – 3 | 20 – 2, 3, 4, 5 |
Цель работы: 1. Изучить спектр свечения молекул йода в видимой области.
2. Определить экспериментально длины волн соответствующих спектральных линий.
На примере спектра поглощения йода можно рассмотреть характерные особенности, присущие молекулярным спектрам.
В то время как атомные спектры состоят из отдельных линий, молекулярные спектры при наблюдении в прибор средней разрешающей силы представляются состоящими из полос (рис.1).
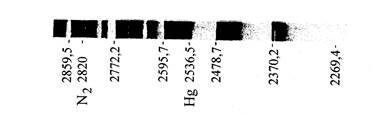
рис. 1
При применении приборов высокой разрешающей силы обнаруживается, что полосы состоят из большого числа тесно расположенных линий (рис.2).

рис.2
В соответствии с их характером спектры молекул носят название полосатых спектров. В зависимости от того, изменение каких видов энергии (электронной, колебательной или вращательной) обусловливает испускание молекулой фотона или его поглощение, различают три вида полос: 1) вращательные, 2) колебательно-вращательные и 3) электронно-колебательные. Полосы на рис. 1 принадлежат к электронно-колебательному типу. Для полос этого типа характерно наличие резкого края, называемого к а н т о м полосы. Другой край такой полосы оказывается размытым. Кант обусловлен сгущением линий, образующих полосу. У вращательных и колебательно-вращательных полос канта нет.
В данной работе рассматриваются только двухатомные молекулы. Различают два вида связи между атомами в молекуле. Один из них осуществляется в том случае, когда электроны в молекуле можно разделить на две группы, каждая из которых все время находится около одного из ядер. Электроны распределяются так, что около одного из ядер образуется избыток электронов, а около другого – их недостаток. Таким образом, молекула как бы состоит из двух ионов противоположных знаков, притягивающихся друг к другу. Связь этого типа называется гетерополярной (или ионной). Примером молекул с гетерополярной связью могут служить NaCl, KBr, HCl и т.д.
Второй вид связи наблюдается в тех молекулах, в которых часть электронов движется около обоих ядер. Такая связь называется гомеополярной (или ковалентной, или атомной). Она образуется парами электронов с противоположно направленными спинами. Примерами молекул с такой связью являются H2, N2, I2, CN и т.д.
Энергия двухатомных молекул, обусловленная электронной конфигурацией (электронная энергия), имеет минимум при некотором значении R и изображается кривой такого вида, как и для водородной молекулы (кривая 1 на рис.3).
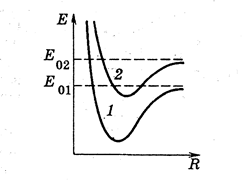
рис.3
Изменение электронной конфигурации молекулы приводит к изменению кривой зависимости электронной энергии от расстояния между ядрами R. Асимптотическое значение энергии также становится иным – равным суммарной энергии изолированных атомов в новом квантовом состоянии (кривая 2 на рис.3).
В основном изменение энергетического запаса молекулы происходит, как и в атоме, в результате изменений в электронной конфигурации, образующей периферическую часть молекулы. Однако при заданной электронной конфигурации ядра молекулы могут различным образом колебаться и вращаться относительно общего центра масс. С этими видами движения связаны запасы колебательной и вращательной энергии, которые должны быть учтены в общем балансе.
Обозначим:
Ee – энергия, обусловленная электронной конфигурацией (электронная энергия);
Ev – энергия, соответствующая колебаниям молекулы (колебательная, или вибрационная, энергия);
Er – энергия, связанная с вращением молекулы (вращательная, или ротационная, энергия).
Тогда, если учесть в первом приближении, что отдельные виды молекулярных движений – движение электронов, колебание и вращение молекулы – можно считать независимыми друг от друга, то полную энергию молекулы можно представить в следующем виде:
Е= Ee+ Ev+ Er
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 379; Нарушение авторских прав?; Мы поможем в написании вашей работы!