
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Функции белков
|
|
|
|
БЕЛКИ
Мономеры и биополимеры
Молекулы, как известно, могут образовываться двумя различными способами. Относительно небольшие молекулы формируются непосредственно из атомов, соединяющихся в тех или иных сочетаниях. Однако строительными блоками молекул могут выступать не только атомы, но и уже готовые молекулы, которые, соединяясь друг с другом, образуют структуры гигантских размеров, называемые макромолекулами. Вещества, построенные из таких макромолекул, носят название полимеров. Полимеры, цепочки, образованные однообразной последовательностью небольших молекул — мономеров, встречаются и в неживой природе (каучук, полиэтилен и т. п.), однако именно в биологических системах полимеры (их называют биополимерами) становятся основным материалом, который и позволяет проявиться специфическим свойствам живой материи. Поэтому иногда биополимеры называют субстратом живого.
Процесс образования биополимеров из мономеров обратим: в желудочно-кишечном тракте животных биополимеры пищи распадаются до молекул-мономеров, которые затем всасываются в кровь, а оттуда поступают в клетки и используются живым организмом для создания тех макромолекул, которые нужны именно этому организму.
В биохимии особую роль играют три класса мономеров: аминокислоты, нуклеотиды и моносахариды. Они служат теми «кирпичиками», из которых затем строятся полимерные биологические макромолекулы — белки, нуклеиновые кислоты и полисахариды. Размер мономеров 0,5 — 1 нм (1/1 000 000 доля мм, 10-6), в то время как макромолекулы достигают размеров от 3 до 300 нм, для сравнения толщина человеческого волоса 0,1 мм.
Всего в организме человека имеется более 5 миллионов типов белковых молекул. У каждого человека есть белки точно такие же, как у всех остальных людей: мужчин и женщин, детей и стариков, негров в Африке, индейцев в Америке, китайцев, эскимосов — всех, всех, всех; другие белки свойственны только этому человеку, но очень похожи на белки его мамы, папы, брата или сестры. Точно так же обстоит дело со всеми животными и растениями: например, у каждого медведя есть общие «медвежьи» белки, а есть его «личные», и у каждой березы есть белки, свойственные всем березам, а есть характерные только для этой березы.
|
|
|
И для построения всех белков, какие только встречаются в живой природе, требуется всего лишь 20 различных аминокислот! При этом число аминокислот в составе белка может быть любым — например, гормон окситоцин составлен всего лишь из девяти аминокислот, а белок гемоглобин, находящийся в эритроцитах (красных клетках крови), — из 600 аминокислот. Но все они относятся только к 20 «видам». Например, если в белке гемоглобине одну из 600 составляющих его аминокислот заменить «неправильной», то и гемоглобин получится «неправильный», настолько, что и кровяные шарики, в состав которых он входит, будут выглядеть не как шарики, а как серпы. Эта болезнь так и называется — серповидноклеточная анемия
Белковые молекулы имеют форму длинных цепей, состоящих из повторяющихся мономеров - аминокислот. Общая формула аминокислот, образующих белок, имеет вид:

Из формулы видно, что к центральному атому углерода присоединены четыре разные группы. Три из них — атом водорода Н, щелочная аминогруппа NH2 и кислая карбоксильная группа СООН - для всех аминокислот одинаковы. По составу и структуре четвертой группы, обозначенной R аминокислоты отличаются друг от друга. В самых простых структурах, например, в молекуле аминокислоты глицина — такая группа представляет собой атом водорода, в молекуле аланина — СН3 и т. д. Таким образом, в состав аминокислот входят все четыре органогена: С, О, Н, N, а в некоторые радикалы может входить сера.
|
|
|
Химическая связь — СО — NH —, соединяющая аминогруппу одной аминокислоты с карбоксильной группой другой в молекулах белков, называется пептидной связью (ковалентная связь).
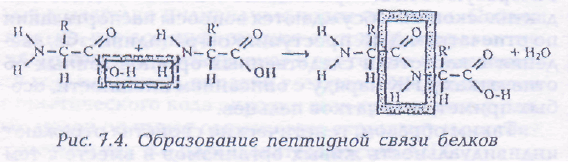
Молекулы аминокислот ассиметричны т.е. обладают молекулярной хиральностью. Это свойство жизни было открыто еще в 40 — 50-е годы XIX в. Л. Пастером в ходе исследования строения кристаллов веществ биологического происхождения — солей виноградной кислоты. В своих опытах Пастер обнаружил, что не только кристаллы, но и их водные растворы способны отклонять поляризованный луч света. Аминокислоты отклоняют поляризованный луч влево, обладая L- конфигурацией,
т.е. они оптически активны. У растворов из веществ небиологического происхождения это свойство отсутствует, строение их молекул симметрично.
Все организмы, будь то растения, животные, бактерии или вирусы, содержат белки, построенные из одних и тех же аминокислот. Поэтому в любой пище содержатся те же аминокислоты, которые входят в состав белков организмов, потребляющих пищу. В организме человека синтезируется 12 аминокислот, 8 должны поступать с пищей (незаменимые). Белок, содержащий тысячи аминокислот, синтезируется в живой клетке за 5 — 6 мин. Но для искусственного создания белка потребовались многолетние опыты и сложнейшая аппаратура, да и то на сегодня ученые научились создавать лишь некоторые, далеко не самые сложные белки. Очень трудно получить белок вне клетки!

Рис. 2. Структурные уровни белковой макромолекулы: А - первичная Б – вторичная В – третичная структура
.
Структуру белковой молекулы, поддерживаемую ковалентными связями между аминокислотными остатками, называют первичной. Под первичной понимают химическую, структурную формулу белка, представленную в виде линейной последовательности аминокислотных остатков и определяющую порядок их чередования. Другими словами, первичная структура белка определяется простой последовательностью аминокислотных остатков как звеньев цепи. После соединения аминокислот в определенной последовательности цепь автоматически закручивается, образуя спираль, в которой отдельные аминокислоты соединены водородной связью т.е. происходит само сборка белковых молекул в трехмерном пространстве (вторичная структура). Если растянуть спираль, а затем ее отпускать, то она всегда будет восстанавливаться в присущую для каждого вида цепи структуру, которая определяется составом и порядком аминокислотных остатков в цепи. Наиболее характерной вторичной структурой является а-спираль, когда аминокислотные цепочки как бы образуют резьбу винта. Одним из самых удивительных свойств макромолекул является то, что а-спирали с левой и правой «резьбой» встречаются в живой природе с существенно разной вероятностью: макромолекул, «закрученных» вправо, почти нет.
|
|
|
Наиболее сложные и тонкие особенности структуры, отличающие один белок от другого, связаны с пространственной организацией белка, которую называют третичной структурой. Фактически речь идет о том, что спиралевидные цепочки аминокислотных остатков свернуты в клубок спиралей (глобулу). В результате довольно длинные цепочки занимают сравнительно небольшой объем в пространстве. Характер свертывания в клубок отнюдь не случаен. Напротив, он однозначно определен для каждого белка. Именно благодаря третичной структуре белок способен выполнять свои уникальные каталитические, ферментативные функции, когда в результате целенаправленного захватывания реагентов осуществляется их синтез в сложные химические соединения, сравнимые по сложности с самим белком. Такая пространственная форма очень чувствительна к температуре окружающей среды. При повышении температуры белок денатурируется — теряет свою пространственную конфигурацию, а вместе с ней и биологические свойства. У живых организмов это происходит при температуре около 60 °С. Кроме третичной структуры, белок может иметь четвертичную структуру, когда имеет место структурная связь между двумя или несколькими белками. Фактически речь идет об объединении нескольких «клубков» из полипептидных цепочек, например, гемоглобин, представляют собой сложный комплекс из 4 глобул (рис. 2)
|
|
|
Белки выполняют все виды «активных работ».
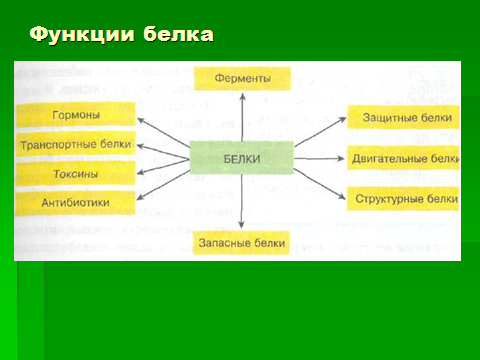
Рис. 3 Функциональная роль белков
Большинство белков выполняет функцию катализаторов (ферментов). Без белков-ферментов невозможны никакие биохимические реакции (а живой организм остается живым только до тех пор, пока в нем ежесекундно осуществляется бесчисленное множество биохимических реакций). В их пространственной структуре есть активные центры в виде углублений определенной формы. В такие центры попадают молекулы, превращение которых катализируется данным белком. Ферменты намного эффективнее неорганических катализаторов и более избирательны: они помогают извлекать из сложной смеси только одно вещество и превращать его не в несколько продуктов, а только в один. Ферменты имеют активный центр; химическое строение их таково, что с ними могут соединяться только вещества, на которые этот фермент действует, — так называемые субстраты. Субстрат — это какая-то молекула, которая после взаимодействия с I ферментом превращается в другую молекулу. Немецким биохимиком Фишером было установлено правило «замок — ключ»: к ферменту (замок) подходит лишь свой субстрат (ключ). Скорость биохимической реакции при наличии фермента может возрасти в 10 миллиардов раз! Примером действия фермента является знакомый всем любителям кошек по запаху процесс разложения мочевины на диоксид углерода и аммиак, который идет при наличии фермента уреазы.
H2N - СО - NH2 + Н2О -* СО2 + 2NH3
мочевина вода диоксид аммиак
углерода
Химическую природу ферментов впервые определил в 1926 г. американский биохимик Дж. Самнер (1887— 1955), лауреат Нобелевской премии 1946 г. Из соевых бобов он выделил в кристаллической форме фермент уреазу и доказал его белковую природу.
Также белки играют транспортную роль: например, гемоглобин переносит кислород от легких к тканям, а углекислый газ — от тканей к дыхательным органам. Мышечные сокращения и внутриклеточные движения — результат взаимодействия молекул белков, функция которых заключается в движении. Есть белки— антитела (глобулины), функцией которых является защита организма от вирусов и бактерий. Белки - гормоны, управляют всеми жизненными процессами в организме, ростом и размножением. Есть в организме и белки- спасатели. Например, белок фибриноген, растворенный в крови; он бесцветен и невидим, но как только где-то повреждается кровеносный сосуд и возникает кровотечение, фибриноген в этом месте быстро превращается в белые нити фибрина и «затыкает» отверстие в стенке сосуда (словно ватным тампоном).
Одна из важнейших функций белков — структурная: по процентному содержанию веществ в клетке белки занимают второе место и определяют, таким образом, белковую природу всех живых организмов. Фибриллярные белки (коллаген, кератин и фиброин шелка) играют структурную роль. Коллаген — наиболее распространенный белок у млекопитающих — образует основу сухожилий, костей, кожи и хрящей. Структурной единицей коллагенового волокна является молекула, состоящая из трех полипептидных цепей, каждая из которых содержит около 1000 аминокислотных остатков (рис 3).
В лабораторных условиях не составляет труда в растворе аминокислот получить пептидные связи и сформировать длинные молекулярные цепи. Однако в таких цепях расположение аминокислот хаотическое, и образовавшиеся молекулы отличаются друг от друга. В то же время в каждом из природных белков порядок расположения отдельных аминокислот всегда один и тот же. А это означает, что при синтезе белка в живой системе используется информация, в соответствии с которой формируется вполне определенная для каждого белка последовательность аминокислот, определяющая пространственную структуру белка.
Нуклеиновые кислоты
Откуда аминокислоты узнают, в каком порядке и количестве им «строиться», чтобы образовать нужный белок? Для этого в клетке существуют нуклеиновые кислоты — ДНК и РНК. Свое название нуклеиновые кислоты (от лат. nucleus — ядро) получили из-за того, что впервые были выделены из ядер лейкоцитов еще во второй половине XIX в. швейцарским биохимиком Ф. Мишером. Позже было обнаружено, что нуклеиновые кислоты могут находиться не только в ядре, но и в цитоплазме (прокариотических клеток и вирусов) и в органеллах клетки (митохондриях и хлоропластах). Нуклеиновые кислотыобразуют самые крупные молекулы, синтезируемые живыми организмами. Они существуют в виде полимерных макромолекул, участвующих в хранении и передаче наследственной информации. Молекулы ДНК вместе с белками-гистонами образуют вещество хромосом. Вторичная структура ДНК была установлена методами рентгеноструктурного анализа в 1953г американским биохимиком Дж. Уотсоном и английским биофизиком и генетиком Ф. Криком удостоенными вместе с английским биофизиком М. Уилкинсоном получившим рентгенограмму ДНК, Нобелевской премии 1962 г.
 Нуклеиновые кислоты — это сложные органические соединения, представляющие собой фосфорсодержащие биополимеры (полинуклеотиды). молекулынуклеиновыхкислот (ДНК и РНК) — только вправо, т. е. обладают пра
Нуклеиновые кислоты — это сложные органические соединения, представляющие собой фосфорсодержащие биополимеры (полинуклеотиды). молекулынуклеиновыхкислот (ДНК и РНК) — только вправо, т. е. обладают пра
вой, или D-конфигурацией.
Существует два типа нуклеиновых кислот — дезоксирибонуклеиновая кислота
(ДНК) и рибонуклеиновая кислота (РНК). Дезоксирибонуклеиновая кислота выполняет функцию носителя генетической информации, а рибонуклеиновая кислота служит для передачи информации от ДНК в ядре к месту синтеза белков в цитоплазме. В управленческой структуре на «фабрике жизни» ДНК представляет законодательную власть, а РНК — исполнительную. РНК не имеет двойной спиральной структуры и построена как часть одной из двух нитей ДНК. Молекулы РНК бывают трех видов: матричная или информационная (мРНК), транспортная (тРНК) и рибосомная (рРНК). Молекула мРНК является копией (транскриптом) с участкасоответствующей ДНК- матрицы. мРНК служит в свою очередь матрицей для синтеза белка с участием рибосом. Каждые три нуклеотида мРНК (они называются кодоном) кодируют одну аминокислоту. Молекулы тРНК в процессе синтеза белка переносят специфичные аминокислоты к определенному участку мРНК.
Мономерные звенья цепи нуклеиновых кислот называются нуклеотидами. Каждый нуклеотид состоит из трех частей: азотсодержащего основания, пятиуглеродного сахара (пентозы) и одной фосфатной группы, соединенных ковалентными связями (рис. 4).
Фосфорная кислота Сахар Азотистое основание

|
Рис 4. Строение нуклеотида
Азотистые основанияя входящие в состав нуклеиновых кислот это: тимин (Т), аденин (А), (урацил (У), гуанин (Г), цитонин (Ц), такие же названия имеют и нуклеотиды. Порядок расположения нуклеотидов в молекулах ДНК и РНК определяет порядок расположения аминокислот и их воспроизведение в первичных структурах белков. Таким образом, через молекулы ДНК и РНК передается информация о наследственных свойствах биологических структур и реализуется механизм наследственности. В рибонуклеиновой кислоте (РНК) сахаром является углевод рибоза (С5Н10О5)) а в дезоксирибонуклеиновой кислоте (ДНК) — углевод дезоксирибоза (С5Н10О4), который отличается от рибозы только тем, что около одного из атомов углерода ОН-группа заменена на атом водорода. «Алфавит» каждой из нуклеиновых кислот состоит всего из четырех «букв», Три из указанных азотистых оснований — Г, А и Ц — входят в состав и РНК, и ДНК. Четвертое азотистое основание в этих кислотах разное — Т входит только в ДНК, а У — только в РНК. РНК содержит 4 — 6 тыс. нуклеотидов, ДНК — 10 — 25 тыс. Если бы можно было вытянуть ДНК одной человеческой клетки в непрерывную нить, то ее длина составила бы 91 см.,
Молекула ДНК похожа на веревочную лестницу: «кусочки», которых она состоит и которые называются нуклеотиды, соединяются между собой вдоль и поперек. веревочной лестницей, где роль «веревок» играют сахаро-фосфатные остовы, «перекладин» — основания, расположенные перпендикулярно оси спирали. Каждая перекладина образована двумя основаниями, присоединенными к двум противоположным цепям, причем если у одного основания одно кольцо, то у другого — два. Таким образом, образуются комплиментарные пары: А-Т и Г-Ц связанные водородными связями. При этом аденин всегда распознает только тимин и связывается с ним двумя водородными связями, и наоборот. Гуанин и цитозин связаны тремя водородными связями. Такие пары оснований, как и нуклеотиды, называются комплементарными (. (рис.5, 6).
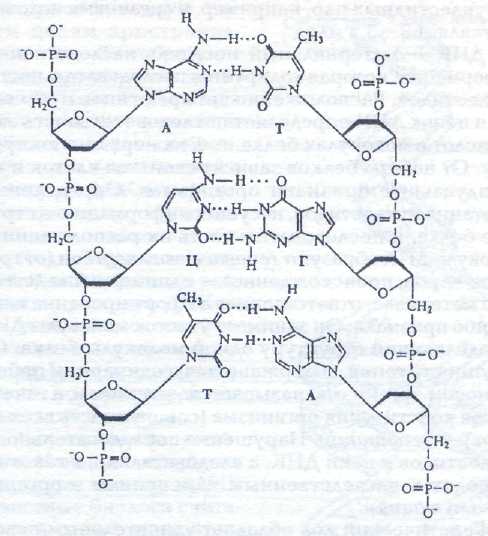
Рис. 5. Ковалентные связи между сахаром и фосфатной группой в одинарной цепочке и водородные связи между комплементарными азотистыми основаниями
Комплементарность – дополнение. Азотистые основания комплементарны попарно (дополняют друг друга до целого как две половинки одного разбитого стекла)
ДНК РНК
А - Т А – У
Ц - Г Ц - Г
Это значит, что последовательность оснований одной цепи однозначно определяет последовательность оснований в другой, комплементарной цепи молекулы ДНК. Количество нуклеотидных пар, например, в генотипе человека составляет 3 — 3,5 млрд (рис.6).
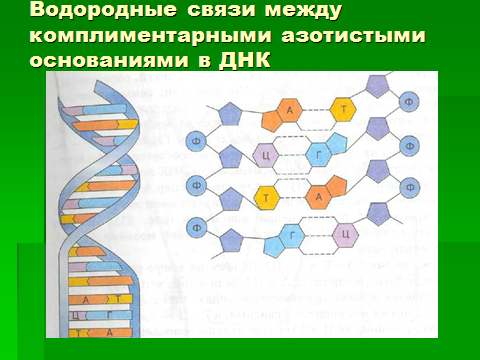
Рис. 6. Принцип комплементарности
Рождение молекулярной генетики произошло, когда американцы Дж. Бидл и Э. Тэйтум установили прямую связь между состоянием генов (ДНК) и синтезом ферментов (белков). Именно тогда появилось знаменитое высказывание «Один ген — один белок». Позже было выяснено, что основной функцией генов является кодирование синтеза белка. После этого ученые сконцентрировали свое внимание на вопросе, как записана генетическая программа и как она реализуется в клетке. Для этого нужно было выяснить, как всего четыре основания могут кодировать порядок расположения в молекулах белка целых двадцать аминокислот. Основной вклад в решение этой проблемы внес знаменитый физик-теоретик Г. Гамов в середине 50-х годов XX в. По его предположению, для кодирования одной аминокислоты используется сочетание из трех нуклеотидов ДНК. Эта элементарная единица наследственности, кодирующая одну аминокислоту в белке, получила название триплета или кодона. Сразу возникает вопрос: сколько различных троек можно получить из четырех «букв»? Легко сообразить, что таких троек может быть 43 = 64. Но в образовании белков может участвовать всего 20 аминокислотных остатков, значит, некоторые из них можно кодировать разными тройками, что и наблюдается в природе. Например, лейцин, серии, аргинин кодируются шестью тройками, пролин, валин и глицин — четырьмя и т. д. Это свойство триплетного генетического кода называется избыточностью генетического кода. Генетический код всего живого, будь то растение, животное или бактерия, одинаков(универсальность кодирования). В 1961 г. гипотеза Гамова была подтверждена исследованиями Ф. Крика. Так был расшифрован молекулярный механизм считывания генетической информации с молекулы ДНК при синтезе белков (рис. 7).
.
 Рис. 7. Генетический код. Триплеты нуклеотидов, ответственные за каждую из 20 аминокислот.
Такая особенность генетического кода вместе со сходством аминокислотного состава всех белков живых организмов свидетельствует о биохимическом единстве
жизни, говорит о происхождении всех живых существ на Земле от единого предка.
Ген (от греч. genos — род, происхождение) — единица наследственного материала, ответственная за формирование какого-либо признака. Он занимает участок молекулы ДНК или РНК (у некоторых вирусов), определяющий структуру одной молекулы белка. Совокупность генов, содержащихся в одинарном (гаплоидном) наборе хромосом данного организма, называется - геномом, а генетическая конституция организма (совокупность всех его генов) — генотипом. Нарушение последовательности нуклеотидов в цепи ДНК, а следовательно, в генотипе приводит к наследственным изменениям в организме - мутациям (рис.8.)
Рис. 7. Генетический код. Триплеты нуклеотидов, ответственные за каждую из 20 аминокислот.
Такая особенность генетического кода вместе со сходством аминокислотного состава всех белков живых организмов свидетельствует о биохимическом единстве
жизни, говорит о происхождении всех живых существ на Земле от единого предка.
Ген (от греч. genos — род, происхождение) — единица наследственного материала, ответственная за формирование какого-либо признака. Он занимает участок молекулы ДНК или РНК (у некоторых вирусов), определяющий структуру одной молекулы белка. Совокупность генов, содержащихся в одинарном (гаплоидном) наборе хромосом данного организма, называется - геномом, а генетическая конституция организма (совокупность всех его генов) — генотипом. Нарушение последовательности нуклеотидов в цепи ДНК, а следовательно, в генотипе приводит к наследственным изменениям в организме - мутациям (рис.8.)
|
Рис 9. Репликация ДНК
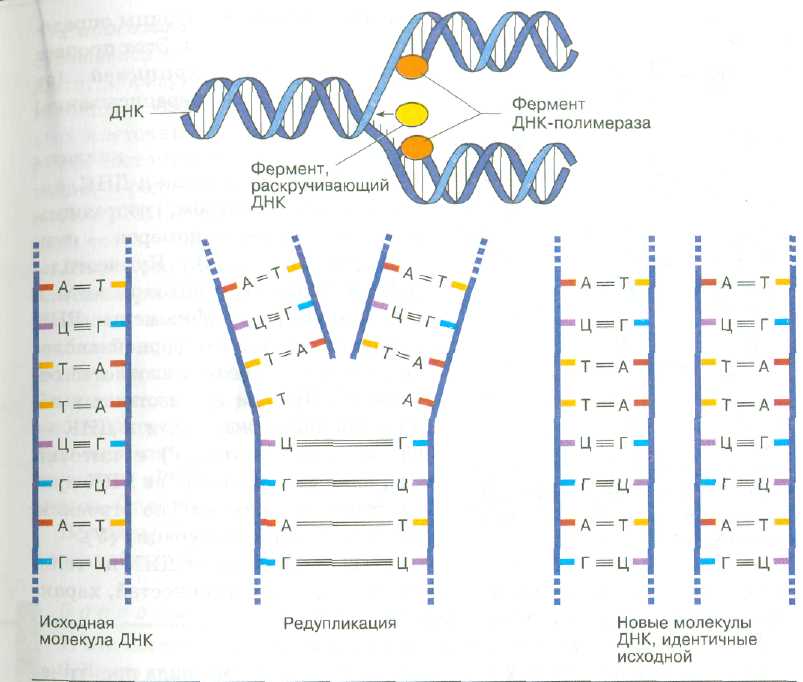
|

|
Рис. 8. Мутации, возникающие при удвоении ДНК
Для молекул ДНК характерно важное свойство удвоения — образования двух одинаковых двойных спиралей, каждая из которых идентична исходной молекуле. Такой процесс удвоения молекулы ДНК называется репликацией. Репликация включает разрыв старых и формирование новых водородных связей, объединяющих цепи нуклеотидов. В начале репликации две старые цепи начинают раскручиваться и отделяться друг от друга (рис. 9).

Рис.10. Транскрипция и трансляция в клетке
Транскрипция — это перенос информации о структуре белка, выраженной в последовательности триплетов нуклеотидов с ДНК матрицы (участка ее цепи - гене) на информационную РНК при ее синтезе с участием фермента РНК-полимеразы. Трансляция - перевод информации, выраженной в последовательности нуклеотидов в мРНК в последовательность аминокислот в белковой молекуле в процессе ее синтеза. Синтез белка происходит в цитоплазме клетки на основе генетического кода и-РНК по принципу комплементарности с участием органелл — рибосом, куда транспортные РНК (более двух десятков видов) доставляют нужные аминокислоты. Сборка одной молекулы белка, состоящей из 200 — 300 аминокислот, происходит при участии ферментов за 1 —2 мин. и требует сравнительно больших затрат энергии (рис.10,11).

|
Рис 11. Трансляция
.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 1723; Нарушение авторских прав?; Мы поможем в написании вашей работы!