
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Толыктыру керек 2 страница
|
|
|
|
1) Кельвин бойынша: нәтижесі жалғыз ғана қыздырғыштан алған жылуы оған баламалы жұмысқа айналу болып табылатын дөңгелек процесс мүмкін емес.
2) Клаузиус бойынша: төмен қыздырылған денеден, жоғары қыздырылған денеге жылудың берілуі жалғыз нәтижесі болып саналатын дөңгелек процесс мүмкін емес.
Термодинамиканың үшінші бастамасы — абсолюттік нөлге жуық температура маңында, реакцияның жылу эффектісі мен максимал жұмысты сипаттайтын қисық сызықтар өзара бірігіп кетеді, ал олардың ортақ жанамасы температуа осіне параллель болады дейтін, химиялық реакцияларға тән эксперименттік нәтижелерді қорытындылаудан туатын постулат.
Термодинамиканың үшінші бастамасы – Нернст-Планк теориясы Кельвиндік нольде (абсолюттік ноль) термодинамикалық жүйенің жағдайын постулаттайды: тепе-теңдік күйде барлық дененің энтропиясы температураның Кельвиндік нолге жуықтаутау шамасына қарай нольге ұмтылады.
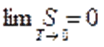
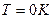 болғанда, жылу сыйымдылықтар
болғанда, жылу сыйымдылықтар  және
және 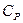 нолге тең болғандықтан
нолге тең болғандықтан
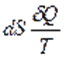 ,
, 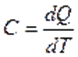 ,
, 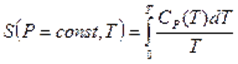 ,
, 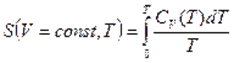 .
.
9.Термодинамиканың бірінші бастамасы
Жылу құбылыстарында таралған энергияның сақталу және айналу заңы термодинамиканың бiрiншi заңы болып табылады. Жалпы жағдайда, жүйенiң бiрiншi U1 күйден екiншi U2 күйге ауысуы кезiнде, iшкi энергия атқарылған жұмыстың есебiнен қалай өзгерсе, жүйеге сырттан берілген жылудың әсеріненде солай өзгере алады. Термодинамиканың бiрiншi заңы нақ осылай тұжырымдалады: iшкi энергияның өзгерiсi жүйеге берiлген жылу мөлшерi мен сыртқы күштердiң жұмысының қосындысына тең:
ΔU = A + Q. (1)ТД-ның бірінші бастамасының дифференциалдық түрдегі теңдеуі:
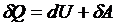 . (2)
. (2)
жұмыс пен жылу – термодинамикалық жүйе күйінің өзгеру процестерінің энергетикалық сипаттамасы. идеал газ сыртқы күштерге қарсы жұмыс атқарса, элементар жұмыс оң болады: 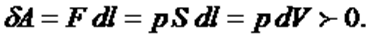
жүйе бір күйден екіншіге ауысқанда (1→2) атқарылған жұмыс:
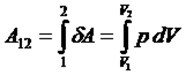
жүйе периодты түрде бастапқы күйіне қайтып оралып тұрса, оның ішкі энергиясы өзгермейді: 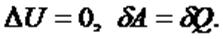
1 моль идеал газ үшін ТД-ның бірінші бастамасының теңдеуі:

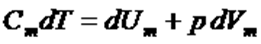 . (3)
. (3)
адиабаттық процесс үшін Термодинамиканың бірінші бастамасы: 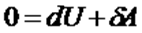 . (4)
. (4)
10. А диабаттық процес
Қоршаған сыртқы ортамен жылу алмаспай 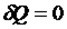 орындалатын процесті адиабаттықдеп атайды. Сыртқы орта мен жүйе арасында жылу алмасып үлгере алмайтындай уақытта тез өтетін процестер адиабаталық процесс ретінде қарастырылады. Оған мысалы, дыбыстың ауада таралуы, жылу қозғалтқыштарының цилиндрі ішіндегі газдың сығылуы т.б. жатады. Адиабаталық процесс қайтымды және қайтымсыз процесс түрінде өтуі мүмкін. Адиабаттық процесс теңдеуі:
орындалатын процесті адиабаттықдеп атайды. Сыртқы орта мен жүйе арасында жылу алмасып үлгере алмайтындай уақытта тез өтетін процестер адиабаталық процесс ретінде қарастырылады. Оған мысалы, дыбыстың ауада таралуы, жылу қозғалтқыштарының цилиндрі ішіндегі газдың сығылуы т.б. жатады. Адиабаталық процесс қайтымды және қайтымсыз процесс түрінде өтуі мүмкін. Адиабаттық процесс теңдеуі: 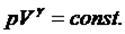 (1)
(1)
мұндағы 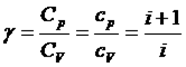 - адиабата көрсеткіші. температура мен көлем арқылы жазылуы:
- адиабата көрсеткіші. температура мен көлем арқылы жазылуы: 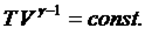 (2)
(2)
температура мен қысым арқылы жазылуы: 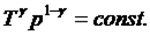 (3)
(3)
адиабаттық процесс үшін термодинамиканың бірінші бастамасы:
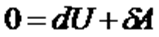 . (4)
. (4)
Яғни
1) 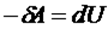 , сыртқы күштердің жұмысы есебінен газдың ішкі энергиясы артады, яғни
, сыртқы күштердің жұмысы есебінен газдың ішкі энергиясы артады, яғни 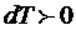 .
.
2) 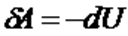 , газішкі энергиясының кемуі есебінен сыртқы күштерге қарсы жұмыс атқарады, яғни
, газішкі энергиясының кемуі есебінен сыртқы күштерге қарсы жұмыс атқарады, яғни 
адиабаттық процесте атқарылатын жұмыс:

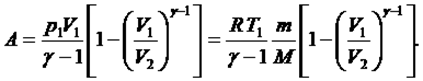 (5)
(5)
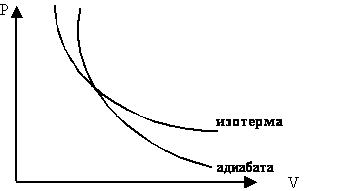
Адиабаталық процесті сипаттайтын графикті адиабата деп атайды.
11. Политроптық процесс
Газ күйінің өзгеруін сипаттайтын изотермдік және адиабаттық процестер политроптық деп аталатын жалпы процестің дербес түрлері болады.яғни Изотермиялық процесс кезінде жүйенің қоршаған ортамен немесе термостатпен идеалды жанасуы талап етілсе, адиабаталық процесс кезінде жүйенің қоршаған ортадан идеалды оқшаулануы талап етіледі. Бұл екі процесті политроптық процесс деп аталатын жалпы процестің дербес жағдайлары деп қарастыруға болады.
Политроптық процестер деп жүруі кезінде жылу сыйымдылығы тұрақты болып қалатын процестерді айтады.
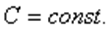 Политроп теңдеуі-
Политроп теңдеуі- 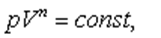
мұндағы: 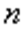 - политроп көрсеткіші.
- политроп көрсеткіші.
Жылу сыйымдылығы мен политроп көрсеткішінің арасындағы байланыс:
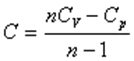 .
.
12. Циклдық процестер. Карно циклы. Карно теоремалары.
Карно циклы екі изотермиядан 1-2 және 3-4 және екі адиабаттан 2-3 және 4-1 тұрады.
Карно, шексіз жай ағатын 1-2-3-4 процессті қарастырған, жұмыстық денемен температура көзі Т 1 арасындағы, 1-2 изотерма бойында және Т 2, 3-4 бойында шексіз аздаған температура айырмашылығы бар. Сонымен, термиялық тепе-теңдік сақталады. Сондықтан, цикл, қайтымды деп саналады. Бұл циклды, Карноның идеалды циклы деп атайды.
Kepi Карно циклын іске асыру үшін, барлығы екі жылулық көзі қажет – жылу
беруші және жылу қабылдағыш. 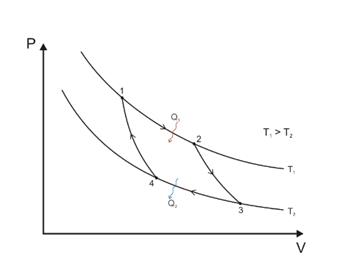
Карно машинасындағы жұмыс атқарушы дене, өз күйiнiң өзгеру циклiн периодты түрде қайталап тұратын, идеалды газ болып табылады. Бұл цикл Карно циклi болып табылады, осыған ұқсас процесстер айналмалы немесе циклдық процесстер деп аталады.
Карно машинасында үйкелiске және қоршаған ортамен жылу алмасуға кеткен энергиялардың шығындары ескерiлмейдi, сондықтан бұл машинаны Карноның идеалды жылу машинасы деп атайды.
Карноның қайтымды циклының ПӘК: 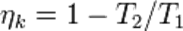
Бірінші теоремасы -жылулық қозғалтқыштың пайдалы әсер коэффициенті туралы теорема. Карно теоремасы бойынша Карно циклінің пайдалы әсер коэффициенті ηк =(T1–T2)/T1, мұндағы T1 – қыздырғыштың температурасы, T2 – суытқыштың температурасы. жұмыстық дененің табиғатына және жылулық қозғалтқыштың құралымына тәуелді болмайды, ол тек қыздырғыш (T1) пен суытқыштың (T2) температураларымен ғана анықталады.
Екінші теоремасы -соққы теориясында – абсолют серпімсіз соққы кезіндегі кинетикалық энергияның кемуі жайлы теорема.Соққы кезіндегі жүйенің кинетикалық энергиясының кемуі, жүйе нүктелерінің кеміген жылдамдықпен қозғалған кезіндегі кинетикалық энергиясына тең.
13.Энтропия. Клаузиус теңсіздігі.
Дөңгелек Карно процесіндегі жұмыстық дененің күйінің өзгерісін қарастырайық.  қысым және
қысым және  температурамен сипатталатын жұмыс-тық денені алғашқы
температурамен сипатталатын жұмыс-тық денені алғашқы 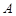 күйінен алдымен изотермдік, содан кейін адиабаттық ұлғайтып, С күйге өткіздік. Осы С күйде оныңтемпера-турасы тоңазытқыштыкімен теңелді. Жұмыстық дененің С күйден кері А күйге оралуы, бірінің соңынан бірі өткізілген екі изотермдік және адиабаттық сығылу арқылы жүзеге асырылды. Алғашқы күйіне қайту кезінде жұмыстық дененің шығарған жылуы
күйінен алдымен изотермдік, содан кейін адиабаттық ұлғайтып, С күйге өткіздік. Осы С күйде оныңтемпера-турасы тоңазытқыштыкімен теңелді. Жұмыстық дененің С күйден кері А күйге оралуы, бірінің соңынан бірі өткізілген екі изотермдік және адиабаттық сығылу арқылы жүзеге асырылды. Алғашқы күйіне қайту кезінде жұмыстық дененің шығарған жылуы 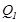 қыздырғыштан алған
қыздырғыштан алған 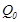 -дан кіші, демек
-дан кіші, демек 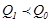 . Сондықтан дененің А күйден С күйге тура өтуіндегі жұтылған, оның С күйден А- ға қайтуындағы шығарған жылу мөлшерлерітең болмайды. Бұл екі процестің әр түрлі жолдармен (7.3-сурет) өтуіне байланысты:бірінші кезеңдегі (А- дан С -ға)ұлғаю процесі екінші кезеңдегі сығылу процесінің (С -дан А -ға) қысымынан жоғары жағдайда өтеді. Осыдан өте маңызды қорытынды шығады.Бір күйден екінші күйге өту кезінде денеге берілген немесе одан алынған жылу мөлшері олардың бастапқы және соңғы күйлеріне емес, сол өту жолдарының тәсілдеріне байланысты болады. Басқаша айтқан-да,
. Сондықтан дененің А күйден С күйге тура өтуіндегі жұтылған, оның С күйден А- ға қайтуындағы шығарған жылу мөлшерлерітең болмайды. Бұл екі процестің әр түрлі жолдармен (7.3-сурет) өтуіне байланысты:бірінші кезеңдегі (А- дан С -ға)ұлғаю процесі екінші кезеңдегі сығылу процесінің (С -дан А -ға) қысымынан жоғары жағдайда өтеді. Осыдан өте маңызды қорытынды шығады.Бір күйден екінші күйге өту кезінде денеге берілген немесе одан алынған жылу мөлшері олардың бастапқы және соңғы күйлеріне емес, сол өту жолдарының тәсілдеріне байланысты болады. Басқаша айтқан-да, 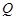 жылу мөлшері ішкі энергия немесе еркін энергия сияқты дене-нің күйінің функциясы болмайды. Бұл теродинамиканың бірінші бастамасынан белгілі. Онда
жылу мөлшері ішкі энергия немесе еркін энергия сияқты дене-нің күйінің функциясы болмайды. Бұл теродинамиканың бірінші бастамасынан белгілі. Онда 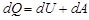 , себебі дененің
, себебі дененің 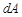 жұмы-сы қандай жолмен атқарғанына байланысты, ал
жұмы-сы қандай жолмен атқарғанына байланысты, ал 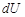 ішкі энергиясы оның күйі қалай өзгеретініне тәуелсіз болады. Бұл айтылғаннан
ішкі энергиясы оның күйі қалай өзгеретініне тәуелсіз болады. Бұл айтылғаннан 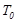 температурада жұмыстық денеге берілген
температурада жұмыстық денеге берілген 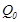 жылу мөлшері, оның
жылу мөлшері, оның 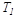 температурада тоңазытқышқа берген
температурада тоңазытқышқа берген 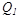 жылуына тең болмаса да,осы жылулардың жұтылу немесе берілу температураларына қатысы сан жағынан бір-біріне тең, бірақ таңбалары әр түрлі (қарама-қарсы), яғни:
жылуына тең болмаса да,осы жылулардың жұтылу немесе берілу температураларына қатысы сан жағынан бір-біріне тең, бірақ таңбалары әр түрлі (қарама-қарсы), яғни: 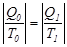 .Мұндағы
.Мұндағы 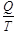 – қатынасын келтірілген жылу деп атайды. Онда дөңгелек процесте жұмыстық дененің қабылдаған және одан берілген келтірілген жылулары тең болады Бұл жылудың ерекшелігі физикада өте маңызды іргелі – энтропия деген шаманы анықтауға мүмкіндік береді. Шарт бойынша
– қатынасын келтірілген жылу деп атайды. Онда дөңгелек процесте жұмыстық дененің қабылдаған және одан берілген келтірілген жылулары тең болады Бұл жылудың ерекшелігі физикада өте маңызды іргелі – энтропия деген шаманы анықтауға мүмкіндік береді. Шарт бойынша 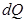 жылу оң таңбалы, егер ол жұтылса, және теріс таңбалы, егер жүйеден ол шығарылса. Егер жүйе күйінің өзгеру нәтижесінде А күйден
жылу оң таңбалы, егер ол жұтылса, және теріс таңбалы, егер жүйеден ол шығарылса. Егер жүйе күйінің өзгеру нәтижесінде А күйден 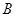 күйге қайтымды жолмен өтетін болса, онда келтірілген жылу мөлшерлерінің қосындысы, демек
күйге қайтымды жолмен өтетін болса, онда келтірілген жылу мөлшерлерінің қосындысы, демек 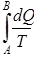 , А -дан В -ға өту жолына тәуелді болмайды. Дөңгелек процестің бастапқы және соңғы күйлері бірдей, сондық-тан бұл интеграл нолге тең болады:
, А -дан В -ға өту жолына тәуелді болмайды. Дөңгелек процестің бастапқы және соңғы күйлері бірдей, сондық-тан бұл интеграл нолге тең болады: 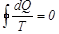 . Күйінің өзгеру нәтижесінде G дене дөңгелек процесс атқарады делік. Процесс кезінде дене жылуды берді және өзі қабылдады, демек жұтты. G дененің шығарған жылуы жылусыйымдылығы өте үлкентемпературасы
. Күйінің өзгеру нәтижесінде G дене дөңгелек процесс атқарады делік. Процесс кезінде дене жылуды берді және өзі қабылдады, демек жұтты. G дененің шығарған жылуы жылусыйымдылығы өте үлкентемпературасы 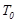 жылу резервуарына берілді делік. Бұл процесті қай-тымды жолмен өткізуге болады, мысалы дөңгелек Карно циклін атқа-ратын қосымша дене арқылы. Онда G дене қосымша денеге қыздыр-ғыш ретінде, ал резервуар – тоңазытқыш болады.Карно циклін (7.3-сурет) қарастырғанда, біз айтып кеткенбіз
жылу резервуарына берілді делік. Бұл процесті қай-тымды жолмен өткізуге болады, мысалы дөңгелек Карно циклін атқа-ратын қосымша дене арқылы. Онда G дене қосымша денеге қыздыр-ғыш ретінде, ал резервуар – тоңазытқыш болады.Карно циклін (7.3-сурет) қарастырғанда, біз айтып кеткенбіз 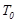 температурада G денеден алынған
температурада G денеден алынған 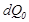 жылу мөлшері және резер-вуарға
жылу мөлшері және резер-вуарға 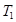 температурада берілген
температурада берілген 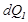 жылу мөлшері бір-біріне тең болмайды, бірақ олардың сәйкес температураға қатынастары тең, демек
жылу мөлшері бір-біріне тең болмайды, бірақ олардың сәйкес температураға қатынастары тең, демек 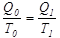 .Сондықтан
.Сондықтан 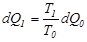 .Егер
.Егер 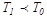 , резервуар тоңазытқыштың ролін атқарады, ал G дене - қыздырғыштың. Егер
, резервуар тоңазытқыштың ролін атқарады, ал G дене - қыздырғыштың. Егер 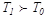 болса, онда резервуар мен G дененің рольдері ауысады. G дене дөңгелек процесті аяқтағанда, оның жоғалтқан жылу мөлшері (7.22)-ші өрнек бойынша былай анықталады:
болса, онда резервуар мен G дененің рольдері ауысады. G дене дөңгелек процесті аяқтағанда, оның жоғалтқан жылу мөлшері (7.22)-ші өрнек бойынша былай анықталады: 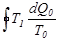 .Бірақ резервуардың жылу сыйымдылығы өте үлкен, сондықтан оның температурасы өзгермейді, демек
.Бірақ резервуардың жылу сыйымдылығы өте үлкен, сондықтан оның температурасы өзгермейді, демек 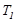 -ді интегралдың сыртына шығаруға болады:
-ді интегралдың сыртына шығаруға болады: 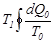 .Өткен процесс дөңгелек, сондықтан соңында ешқандай өзгерістер байқалмайды. Аралық денеде де дөңгелек процесс өтті, сондықтан онда да ешқандай өзгерістер болмайды.Егер (7.21)-ші интеграл оң таңбалы болса, онда дененің жоғалтқан
.Өткен процесс дөңгелек, сондықтан соңында ешқандай өзгерістер байқалмайды. Аралық денеде де дөңгелек процесс өтті, сондықтан онда да ешқандай өзгерістер болмайды.Егер (7.21)-ші интеграл оң таңбалы болса, онда дененің жоғалтқан 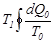 жылу мөлшері толығымен жұмысқа айналатын еді. Бірақ не G дене, не аралық дене өздерінің күйлерін өзгертпеді. Бұл жоғарыда айтылған Кельвиннің принципі бойынша мүмкін емес. Онда,
жылу мөлшері толығымен жұмысқа айналатын еді. Бірақ не G дене, не аралық дене өздерінің күйлерін өзгертпеді. Бұл жоғарыда айтылған Кельвиннің принципі бойынша мүмкін емес. Онда, 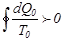 деген болжам да мүмкін болмайды. (7.21)-ші интеграл терісте бола алмайды. Шынында, барлық өзгерістерді кері өткізсек, онда әр жылу мөлшері өзінің таңбасын өзгертеді. Егер тура процесте
деген болжам да мүмкін болмайды. (7.21)-ші интеграл терісте бола алмайды. Шынында, барлық өзгерістерді кері өткізсек, онда әр жылу мөлшері өзінің таңбасын өзгертеді. Егер тура процесте 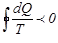 , онда кері процесті бұл инте-грал оң таңбалы болады, бірақ, біз айтып кеткендей, бұл мүмкін емес. Сондықтан, бұл интеграл теріс таңбалы бола алмайды. Егер интеграл не оң, не теріс бола алмаса, онда біз қарастырған қайтымды дөңгелек процестер үшін ол нольге тең болады, яғни
, онда кері процесті бұл инте-грал оң таңбалы болады, бірақ, біз айтып кеткендей, бұл мүмкін емес. Сондықтан, бұл интеграл теріс таңбалы бола алмайды. Егер интеграл не оң, не теріс бола алмаса, онда біз қарастырған қайтымды дөңгелек процестер үшін ол нольге тең болады, яғни 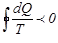 .Осыдан кез келген қайтымды дөңгелек емес процесте
.Осыдан кез келген қайтымды дөңгелек емес процесте 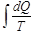 инте-гралдың мәні процестің өту жолына тәуелді болмайды.Онда процесті сипаттайтын күй функциясы болатын бір шама бар екен, оны
инте-гралдың мәні процестің өту жолына тәуелді болмайды.Онда процесті сипаттайтын күй функциясы болатын бір шама бар екен, оны 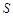 әрпімен белгілейік. Жүйе А күйден В күйге қайтымды өткенде, осы күй функциясының өзгерісі былай анықталады:
әрпімен белгілейік. Жүйе А күйден В күйге қайтымды өткенде, осы күй функциясының өзгерісі былай анықталады: 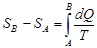 . осы функцияның өзгерісін бір күйден екіншіге өткенде ғана анықтауға болады. Абсолюттік мәні анықталмайды. Бірақ бір күйді белгілеп, ондағы
. осы функцияның өзгерісін бір күйден екіншіге өткенде ғана анықтауға болады. Абсолюттік мәні анықталмайды. Бірақ бір күйді белгілеп, ондағы 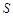 функциясының мәнін нолге тең деп, сонымен жүйенің басқа күйлерін салыстыруға болады. Сондықтан, осы айтылғанды ескере отырып, (7.21)-ші формула бойынша анықталатын интегралға
функциясының мәнін нолге тең деп, сонымен жүйенің басқа күйлерін салыстыруға болады. Сондықтан, осы айтылғанды ескере отырып, (7.21)-ші формула бойынша анықталатын интегралға 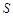 функция тең дейміз, демек
функция тең дейміз, демек 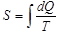 .Осылай анықталған
.Осылай анықталған 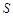 шаманы энтропия деп атайды.
шаманы энтропия деп атайды.
14.Термодинамиканың екінші бастамасының статистикалық сипаты, күй ықтималдығымен байланысы. Больцман өрнегі.
Термодинамиканың екінші бастамасы қайтымсыз процестерде энтропия өсіп, жүйенің тепе-теңдік күйіне сәйкес максималмәніне жететінін тағайындайды. Энтропияның өсуі жылулық процестің өтуі-мен байланысты. Мұнда шашыраған энергия ешқашан қайтарыл-майды, бұл энергияның шашырауының қайтымсыздығы макроскоп-тық деңгейдегі тәжірибенің нәтижесі. Дененің жылулық энергиясы оның құрамындағы молекулалардың ретсіз, хаосты қозғалысының энергиясымен анықталады. Олай болса, термодинамиканың екінші заңына бағынатын макроскоптық деңгей-дегі энергияның өзгерісінің қайтымсыздығы, микроскоптық деңгейде толығымен молекулалардың қайтымды әрекеттесуімен сипатталады. Сонымен, жылулық энергияның механикалыққа айналуы хаосты жылу-лық қозғалысты ретті қозғалысқа айналдырады. Керісінше, механикалық энергияны жылулыққа айналдыру деген реттік энергияны ретсіздік энергияға айналдыру деп айтуға болады
15.Молекулааралық әсерлесулердің потенциалы мен күштері.
Нақты газдардың сұйыққа айналуы үлкен қашықта молекулалар арасында тартылыс күштері болатыны туралы болжау жасатады. Сұйықтардың сығылуға қатты қарсылығы, қашықтық бойынша күрт өзгеретін, жақыннан әсер ететін тебу күштері болатынын білдіреді. Екі сфералық молекула арасындағы өзара әрекеттесу F күші молекулааралық қашықтықтың r функциясы болады. Молекулааралық әрекеттесуді зерттегенде 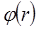 өзара әрекеттесуінің потенциалдық энергиясын немесе потенциалын қолдану қолайлы. Осы екі
өзара әрекеттесуінің потенциалдық энергиясын немесе потенциалын қолдану қолайлы. Осы екі 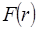 және
және 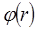 функциялары өзара қарапайым қатынаста болады:
функциялары өзара қарапайым қатынаста болады:
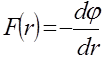 ,
, 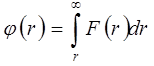 . (5.6)Молекулааралық күштерді екі топқа бөледі: алыстан әсерлесу күші және қысқа әсер күші. Егер электронды бұлттары қиылыспайтын қашықта екі молекула орналасса, онда олардың арасында алыстан әсерлесу күштері немесе өзара тартылыс күштері байқалады. Тартылыс күштері молекула-аралық қашықтықтың әр түрлі дәрежесіне кері пропорционал өзгереді және теріс таңбалы:
. (5.6)Молекулааралық күштерді екі топқа бөледі: алыстан әсерлесу күші және қысқа әсер күші. Егер электронды бұлттары қиылыспайтын қашықта екі молекула орналасса, онда олардың арасында алыстан әсерлесу күштері немесе өзара тартылыс күштері байқалады. Тартылыс күштері молекула-аралық қашықтықтың әр түрлі дәрежесіне кері пропорционал өзгереді және теріс таңбалы: 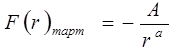 , (5.7)мұндағы А – тұрақты шама, r – сфералық молекулалар центрлері ара-сындағы қашықтық.
, (5.7)мұндағы А – тұрақты шама, r – сфералық молекулалар центрлері ара-сындағы қашықтық.
Молекулалар жақындасқанда, олардың электрондық бұлттары жана-сып, бір-бірін бүркеуі мүмкін, осы кезде өзара қысқа әсер күштері немесе өзара тебу күштері байқалады. Бұл тебу күштерін валенттік күштер немесе химиялық күштер деп те атайды.Екі молекуланың өзара әрекеттесуінің потенциалдық энергиясының өзгеруі 5.5-суретте көрсетілген. Мұнда абсцисс осі бойынша молекулалар центрлері арасындағы r қашықтық, ал ординат осімен 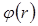 өзара әрекет-тесуінің потенциалдық энергиясы келтірілген. 5.5-суретте кескінделген
өзара әрекет-тесуінің потенциалдық энергиясы келтірілген. 5.5-суретте кескінделген 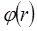 қисығы r қашықтыққа байланысты тез кемиді және
қисығы r қашықтыққа байланысты тез кемиді және 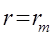 нүкте-сінде минимум болады. Потенциалдық шұңқырдың тереңдігі
нүкте-сінде минимум болады. Потенциалдық шұңқырдың тереңдігі 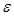 орнықты тепе-теңдік күйіне сәйкес, молекулалардың байланыс энергиясын анық-тайды.
орнықты тепе-теңдік күйіне сәйкес, молекулалардың байланыс энергиясын анық-тайды.  қозғалмайтын молекулалар центрлері арасындағы мүмкін болатын ең кіші қашықтық. Молекулалар бір-бірімен беттеседі, молеку-лааралық күштер нолге тең болады. Егер
қозғалмайтын молекулалар центрлері арасындағы мүмкін болатын ең кіші қашықтық. Молекулалар бір-бірімен беттеседі, молеку-лааралық күштер нолге тең болады. Егер  , онда молекулалар арасында тартылыс күштері әсер етеді. Бұл күштер әлсіз, қашықтық-қа байланысты тез кемиді. Егер
, онда молекулалар арасында тартылыс күштері әсер етеді. Бұл күштер әлсіз, қашықтық-қа байланысты тез кемиді. Егер 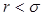 кіші болса, онда молекулалар арасында тебу күштері әсер етеді. 5.5-суреттегі кескінделген
кіші болса, онда молекулалар арасында тебу күштері әсер етеді. 5.5-суреттегі кескінделген 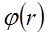 қисы-ғының сол жағы r қашықтыққа бай-ланысты күрт
қисы-ғының сол жағы r қашықтыққа бай-ланысты күрт
өседі, демек 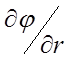 туындының мәндері
туындының мәндері 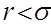 қашық-тарда өте үлкен болады. Бұл екі соқтыққан молекула арасында ора-сан зор тебу күштері пайда болаты-нын көрсетеді. Қатты сфералық моле-кулалар үшін
қашық-тарда өте үлкен болады. Бұл екі соқтыққан молекула арасында ора-сан зор тебу күштері пайда болаты-нын көрсетеді. Қатты сфералық моле-кулалар үшін 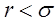 кезінде
кезінде 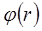 шексіздікке ұмтылады. Олай болса тебу күштері молекулааралық қашықтықтың әр түрлі дәрежесіне кері пропор-ционал өзгереді және оң таңбалы:
шексіздікке ұмтылады. Олай болса тебу күштері молекулааралық қашықтықтың әр түрлі дәрежесіне кері пропор-ционал өзгереді және оң таңбалы:
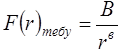 , (5.8)бірақ а<b. (5.6)-шы өрнек бойынша молекулалардың
, (5.8)бірақ а<b. (5.6)-шы өрнек бойынша молекулалардың 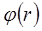 өзара әрекеттесуі-нің потенциалдық энергиясын (5.7) мен (5.8)-ді интегралдап табамыз:
өзара әрекеттесуі-нің потенциалдық энергиясын (5.7) мен (5.8)-ді интегралдап табамыз:
 және
және  . (5.9)
. (5.9)
Айта кету керек, молекулааралық өзара әрекеттесу күштерін Ван-дер-Ваальс күштері деп атайды.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 1777; Нарушение авторских прав?; Мы поможем в написании вашей работы!