
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дыхание. Катаболизм углеводов и жирных кислот
|
|
|
|
Липиды
Бифункциональные природные соединения (6 часов).
Предмет химии природных соединений (2 часа).
Содержание разделов дисциплины
Разделы дисциплины и виды занятий (часы)
Содержание дисциплины
| № п/п | Разделы дисциплины | Лекция | ЛЗ | СРС |
| 1. | Предмет и методология химии природных соединений. | |||
| 2. | Ферменты. Витамины и коферменты. Порфи-рины. Металло-коэнзимы. | |||
| 3. | Бифункциональные природные соединения. | |||
| 4. | Углеводы. Фотосинтез. | |||
| 5. | Липиды. Биосинтез жирных кислот. | |||
| 6. | Дыхание. Катаболизм углеводов и жирных кислот. | |||
| 7. | Аминокислоты. Пептиды. Белки. | |||
| 8. | Нуклеиновые кислоты. Биосинтез белка. | |||
| 9. | Антибиотики. | |||
| 10. | Алкалоиды. |
Природные соединения как многофункциональные органические соединения. Классификация природных соединений: по биологической активности, по источникам природных соединений, химическая (в соответствии с номенклатурой классической органической химии). Биохимическая классификация природных соединений по основным направлениям их биосинтеза: соединения первичного метаболизма – углеводы, аминокислоты и т.д. и вторичного метаболизма – алкалоиды, терпены и т.д. Классификация соединений вторичного метаболизма в соответствии с ключевыми соединениями их биосинтеза: шикиматный путь биосинтеза – шикимовая кислота, мевалоновый путь – мевалоновая кислота, поликетидный путь – поликетиды.

|
Методология химии природных соединений.
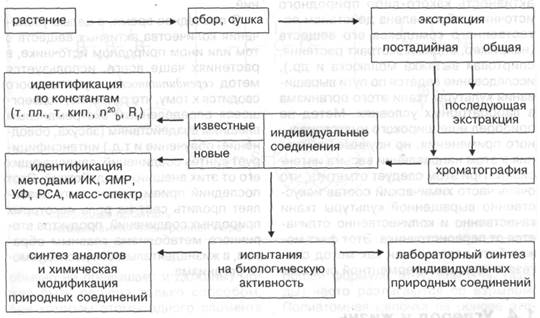
|
4.2.2. Ферменты. Витамины и коферменты. Порфирины. Металло – коэнзимы.
Понятие о ферментативном катализе биохимических процессов in vivo.
Классификация ферментов.
Основные классы ферментов
| Код | Наименование | Катализируемые реакции | Примеры |
| КФ1 | Оксидоредук-тазы | Окислительно-восстанови-тельные реакции | Глюкозооксидаза, каталаза |
| КФ2 | Трансферазы | Перенос различных групп атомов с одной молекулы на другую | ПротеиГлюкоизомеразнкиназа, гликоген-фосфорилаза |
| КФ3 | Гидролазы | Гидролитическое расщеп-ление химических связей субстрата | Протеазы, амилазы |
| КФ4 | Лиазы | Присоединение по двой-ным связям и обратные реакции | Аспартаза, фумараза |
| КФ5 | Изомеразы | Изомеризация органичес-ких соединений | Глюкоизомераза, триозо-фосфатизомераза |
| КФ6 | Лигазы (синтетазы) | Соединение молекул суб-страта с использованием высокоэнергетических соединений, например АТФ | ДНК-лигаза, триптофан-синтетаза |
Ферменты как совокупность апоферментов и коферментов. Коферменты как природные низкомолекулярные органические соединения, необходимые для осуществления каталитического действия ферментов. Витамины, провитамины, витамеры.
Витамины
Витамин А – семейство из трех основных соединений с одинаковой дитерпеновой структурой, содержащей сопряженную полиеновую систему с активирующей кислородной функцией, с ярко выраженной липофильностью: ретинол (витамин А1 –спирт), ретиналь (витамин А1 – альдегид) и ретиноевая кислота (витамин А1 –кислота). Антиоксидантные свойства витамина А (в неполярных средах), обусловленные легкостью окисления аллильного спирта ретинола в ретиналь и, затем, в ретиноевую кислоту. Образование азометиновых производных в сетчатке человеческого глаза между ретиналем и ε-аминогруппой аминокислотного остатка лизина белка опсина с образованием родопсина – светочувствительного элемента зрительной системы. Использование ретинолацетата в лекарственной практике. Нахождение витамина А в природе.
Витамин С (водорастворимая аскорбиновая кислота). Биосинтез аскорбиновой кислоты из глюкозы и галактозы. Получение аскорбиновой кислоты в промышленности из глюкозы. Сопряженная восстановительно–окислительная пара аскорбиновая кислота/дегидроаскорбиновая кислота (φ0´= 0,08 В) как активный антидот свободнорадикальных redox процессов, протекающих в водной среде: предохранение глутатиона и SH-групп белков от окисления, восстановление ионов Fe3+ до ионов Fe2+, регулирование свободно-радикального окисления жирных кислот. Нахождение витамина С в природе.
Витамин D (липидорастворимые кальциферолы D1 – D4). Природный витамер D3, нахождение в природе. Образование витамеров D2 – D4 при УФ – облучении эргостерола и 22,23-дигидрокси-эргостерола соответственно. Витамер D1 как молекулярное соединение люмистерола и витамера D2 в соотношении 1:1. Транспорт ионов кальция сквозь липидный слой, липидную мембрану за счет комплексообразования с дигидроксипроизводными витамеров D1 – D4 (за счет ковалентного и координационного связывания ионов кальция с тремя гидроксильными группами).
Витамин Е (липидорастворимые α-, β-, γ- и δ-токоферолы) как производные бензопирана с изопреноидной цепью. Антиоксидантные свойства α-, β-, γ- и δ-токоферолов определяемые склонностью к окислению гидрохинонового фрагмента их молекул. Зависимость биологической активности от степени замещения атомов водорода бензольного кольца.
Витамин U (водорастворимый метионинметилсульфоний хлорид) – аминокислота метионин, сульфидная группа которой переведена в сульфониевое состояние. Витамин U как донор метильных групп (наряду с S-аденозилметионином) в различных биохимических реакциях (в основном метилирование гидроксильной и аминогрупп).
Витамины - коферменты
Витамин В1 (водорастворимый тиамин) – система из двух гетероциклов (пиримидина и тиазола), причем атом азота тиазольного цикла находится в аммонийном состоянии. Действия витамина В1 как кофермента (в виде тиаминпирофосфата ТПФ): окислительное декарбоксилирование пировиноградной кислоты (фермент: пируват-дегидрогеназа); перенос двухуглеродного фрагмента с карбонильной группой - кетольной группы (фермент: транс-кетолаза).
Витамин В2 (рибофлавин) как предшественник флавиновых коферментов и ферментов, содержащих изоаллоксазиновый фрагмент – флавинаденинмононуклеотида (ФМН) и флавинадениндинуклеотида (ФАД). Окислительно-восстановительные свойства ФМН и ФАД.
Витамин В3 (пантотеновая кислота) как составная часть кофермента А (КоА-SH), катализирующего реакции переноса ацетильной группы. Химические свойства пантотеновой кислоты как типичной гидроксикислоты. Гидролиз до β-аланина и пантолактона.
Витамин В6 (производные 2-метил-3-гидрокси-5-метиленгидрокси-пиридина: пиридоксол, пиридоксаль и пиридоксамин). Пиридоксальфосфат как коферментная форма витамина В6; катализ переаминирования при взаимодействии оксокислот с аминокислотами.
Витамин В12 (кобаламины) – соединения корринового ряда, гловными структурными элементами которых являются тетрапиррольный цикл (корриновый), с внедренным внутрь цикла ионом Со2+, связанного с атомом азота бензимидазольного фрагмента и нуклеофильной подвижной группой Х (-ОН и -СН3 в природном и -CN в синтетическом витамине В12. Обмен -ОН группы в оксикабаламине на метильную и действие метилкабаламина как ацилирующего агента в биосинтезах.
Витамин Вс (В9) – производное фолиевой кислоты, состоящее из трех фрагментов: азотистого гетероцикла птерина, п-аминобензойной кислоты и L-глутаминовой кислоты. Перенос тетрагидрофолиевой кислотой одноуглеродных фрагментов (-СН3, -СН2-, -СН=, -СН=О, -СН=NH) в биосинтезе пуриновых и отчасти пиримидиновых оснований ДНК и РНК.
Витамин Н (биотин) – катализ реакции карбоксилирования органических кислот:
-взаимодействие биотина с СО2 с образованием N-карбокси-лированного производного биотина,
-взаимодействие N-карбоксилированного производного биотина с ацетил-КоА с образованием производных малоновой или щавелевоуксусной кислоты.
Витамин Вг (карнитин) – γ-амино-β-гидроксикарбоновая кислота (в форме бетаина). Транспорт жирных кислот через мембраны из цитоплазмы в митохондрии.
Витамин К (К1 – филлохинон, К2 – менахинон). γ-Карбоксилирование остатка глутаминовой кислоты в протромбине (образование остатка малоновой кислоты в полипептидной цепи. Связывание ионов Са остатком малоновой кислоты – превращение протромбина в тромбин как фактор, вызывающий коагуляцию фибриногена (свертывание крови).
Витамин РР – ниацин (никотиновая кислота и ее амид) – формирование активных центров никотинамидных коферметов: НАД+ и НАДФ+. Диэтиламид никотиновой кислоты (кордиамин) как аналептик.
Коферменты
Аденозинтрифосфат АТФ как универсальный аккумулятор энергии для обеспечения протекания биохимических реакций. Ангидридный характер связей между фосфатными фрагментами – легкость гидролиза (выделяется Е=30,5 КДж/моль). Взаимодействие с нуклеофилами: аминами, спиртами, сульфидами и т.д. Запасание энергии при фотосинтезе и расщеплении жиров и сахаров путем перевода аденозинмонофосфата АМФ и аденозиндифосфата АДФ в АТФ.
Кофермент Q (жирорастворимые пластохиноны – в растениях, убихиноны – в растительных и животных организмах). Основная функция убихинонов – перенос электронов и протонов в процессах дыхания и окислительного фосфорилирования, функция пластохинонов – такая же, но только в процессе фотосинтеза.
S-аденозилметионин как донор метильной группы в реакциях транс-метилирования: сульфониевый атом серы поляризует атом углерода метильной группы (становится электрофильным и может подвергаться атаке нуклеофилом по механизму SN2) и, в итоге, метильная группа переходит к атакующему нуклеофилу (спирты, амины, олефиновые связи и т.д.) и высвобождается S-аденозил-гомоцистеин.
(+)-Липоевая кислота – как работающая в липидной фазе окислительно-восстановительная система, основанная на способности дисульфидной связи восстанавливаться до бис-меркаптанного состояния с образованием дигидролипоевой кислоты. Последняя, в свою очередь, способна легко окисляться вновь до липоевой кислоты. Дигидролипоевая кислота как переносчик ацильных групп. Участие в окислительном фосфорилировании глюкозы, в ускорении гликолиза, в окислительном декарбоксилировании α-оксокарбоновых кислот совместно с тиаминди-фосфатом.
Уридиндифосфатглюкоза (УДФГ) – представитель группы природных нуклеозиддифосфосахаров, катализирующих эпимеризацию моносахаридов, образование гликозидов и полисахаридов и другие реакции углеводов.
Коферменты НАД и НАДФ – производные витамина РР (никотин-амида). Сопряженные окислительно-восстановительные пары НАД+ / НАД(Н) (φ0´= – 0,320 В) и НАДФ+ / НАДФ(Н) (φ0´= – 0,324 В) как активные участники большинства окислительно-восстановительных процессов in vivo.
Кофермент А (КоА или КоА-SH). Образование ацетил- КоА и его роль как донора ацильных групп. Участие в биосинтезе липидов, изопреноидов, фенольных соединений (поликетидный путь синтеза) и др. Катализ реакций цикла трикарбоновых кислот и глиоксилатного цикла.
Дикарбоновые кислоты: щавелевая, малоновая, янтарная и глутаровая.
Особенности химического поведения: образование двух рядов (моно- и ди-) функциональных производных по карбоксильной группе. Двухступенчатая диссоциация дикарбоновых кислот. Декарбоксилирование щавелевой и малоновой кислот при нагревании.
Подвижность атомов водорода метиленовой группы в малоновой кислоте и ее эфирах. Синтезы карбоновых кислот на основе диэтилмалоната (С-алкилирование с последующим омылением сложноэфирных групп и декарбоксилированием). Конденсация ацетил-SKoA c малонил- SKoA как один из этапов биосинтеза жирных кислот.
Окислительное дегидрирование янтарной кислоты в фумаровую под действием ФАД – одна из стадий цикла Кребса. Образование пятичленных и шестичленных циклических ангидридов при нагревании янтарной и глутаровой кислот. Образование внутрикомплексных соединений хелатного типа с металлами переменной валентности (Cu2+).
Гидроксикислоты: Д-глицериновая, молочная, яблочная, лимонная кислоты. Пантовая и (+)-мевалоновая кислоты. Ароматические гидроксикислоты: хинная и шикимовая. Стереоизомерия на примере молочной и винных кислот. Получение α-гидроксикислот взаимодействием карбонильных соединений с синильной кислотой и β-гидроксикислот по реакции Реформатского (взаимодействием альдегидов и кетонов с цинкорганическими соединениями).
Реакции по гидроксильной группе: с галогеноводородными кислотами, образование сложных эфиров, окисление гидроксильной группы до карбонильной как одно из направлений биосинтеза оксокислот (на примере окисления молочной кислоты до пировиноградной). Реакции по карбоксильной группе: образование солей, сложных эфиров. Салициловая кислота и ее производные: по карбоксильной группе – метиловый эфир салициловой кислоты (салол) и по гидроксильной группе – ацетилсалициловая кислота (аспирин).
Химические свойства, обусловленные участием двух функциональных групп: образование межмолекулярных сложных эфиров (лактидов) из α-гидроксикислот и внутримолекулярных сложных эфиров (лактонов) из γ-гидроксикислот. γ-Бутиролактон: реакции с раскрытием цикла –со щелочами и галогеноводородными кислотами и без раскрытия цикла – с аммиаком и метиламином: образование пирролидона-2 и метилпирролидона-2 – заменителя плазмы крови. Дегидратация β-гидроксикислот. Образование внутрикомплексных соединений с металлами переменной валентности (Cu2+).
3-Фосфат Д-глицериновой кислоты как источник основных интермедиатов биохимических процессов: 3-фосфата Д-глицеринового альдегида, пировиноградной кислоты и фосфата ее енольной формы.
Образование пирофосфата 2-метил-бут-1-ен-4-ола путем синхронного элиминирования фрагментов СО2 и Н2О от пирофосфата мевалоновой кислоты как основной путь формирования изопреноидных углеродных систем.
Образование шикимовой кислоты из хинной – ключевого интермедиата биосинтеза ароматических кислородсодержащих соединений (на примере биосинтеза фенолокислот: п-гидроксибензойной и галловой).Кислоты ароматического ряда и их производные как лекарственные средства (на примере салициловой, п-аминобензойной кислот и сульфониламидов).
Оксокислоты: глиоксалевая, пировиноградная, ацетоуксусная, мезоксалевая, щавелевоуксусная, α-оксоглутаровая и левулиновая кислоты. Биосинтез оксокислот путем дегидрирования гидроксикарбоновых кислот с помощью дегидрогеназ с окисленной формой кофермента НАД+ (на примере получения пировиноградной и ацетоуксусной кислот). Получение этилового эфира ацетоуксусной кислоты (ацетоуксусного эфира) из этилацетата сложноэфирной конденсацией по Кляйзену.
Реакции нуклеофильного присоединения по карбонильной группе оксокислот: воды, гидроксиламина, фенилгидразина. Присоединение аммиака как одно из направлений биосинтеза аминокислот (на примере получения аланина из пировиноградной кислоты). Образование важнейшего интермедиата биосинтетических реакций - ацетил-кофермента А при взаимодействии пировиноградной кислоты с коферментом А (HSKoA).
Реакции оксокислот по карбоксильной группе: образование солей и сложных эфиров.
Реакции с расщеплением связи С - С. Декарбоксилирование пировиноградной кислоты в разбавленной серной кислоте, декарбонилирование – в концентрированной. Декарбоксилирование пировиноградной кислоты in vivo под действием декарбоксилазы в присутствии коферментов НАД+ и HSKoA. Самопроизвольное декарбоксилирование ацетоуксусной кислоты. Расщепление связи Сα - Сβ в тиоэфирах β-оксокарбоновых кислот с HSKoA под действием тиолазы и HSKoA.
Реакции с образованием связи С – С. Реакции конденсации альдольного типа: присоединение С-нуклеофила и протона по кратной связи карбонильной группы с образованием гидроксипроизводного дикарбоновой кислоты с разветвленным углеродным скелетом (на примере конденсации двух молекул ацетил-кофермента А). Карбоксилирование оксокарбоновых кислот на примере взаимодействия гидрокарбонат-аниона с пируватом при участии карбоксилазы и АТФ с образованием оксалоацетата и воды.
Восстановление до гидроксикислот в присутствии гидрогеназы с коферментом в восстановленной форме (НАДФ(Н) + Н+). Образование внутрикомплексных соединений с металлами переменной валентности (Cu2+).
Кето-енольная таутомерия. Зависимость соотношения кето- и енолтаутомеров от строения оксокарбоновых кислот (на примере пирувата и оксалоацетата). Анионы сложных эфиров оксокарбоновых кислот (на примере натрийацетоуксусного эфира) как амбидентные нуклеофилы: С – алкилирование и О – ацилирование. Кетонное расщепление ацетоуксусного эфира под действием разбавленных растворов щелочей, кислотное – концентрированных растворов щелочей. Синтезы кетонов и карбоновых кислот из ацетоуксусного эфира.
4.2.4. Угле воды
4.2.4.1. Строение моносахаридов.
Стереоизомерия моносахаридов. Ассиметрический атом углерода, энантиомеры и диастереомеры. Проекции Фишера. D-и L - ряды альдоз и кетоз. Обозначение конфигурации ассиметрических атомов углерода по системе Кана-Прелога-Ингольда (R, S - номенклатура).
Таутомерия моносахаридов. Открытые и полуацетальные формы моносахаридов: a- и β - аномеры. Пиранозные и фуранозные формы. Перспективные формулы Хеуорса. Механизм взаимных переходов тау-томерных форм моносахаридов в растворах. Мутаротация.
Конформационная устойчивость моносахаридов. Конформации "кресло" (4C1 и 1C4) пиранозного цикла полуацетальных форм моносахаридов. Влияние на конформационнуто устойчивость стереохимических (расположение заместителей в пространстве) и стереоэлектронных (электростатические взаимодействия между диполями связей) факторов. Оценка относительной устойчивости конформации "кресло" 4C1 и 1C4 для различных аномеров моносахаридов по факторам неустойчивости: 1,2-вицинальньм и 1,3-аксиальным взаимодействиям заместителей. Влияние растворителей на конформационную устойчивость моносахаридов.
4.2.4.2. Превращения моносахаридов под влиянием кислот и оснований
Наличие оксикарбонильной группировки как фактор, обуславливающий неустойчивость моносахаридов к действию кислот и оснований. Енолизация моносахаридов в кислых и щелочных средах с образованием ендиола.
Превращения моносахаридов в щелочной среде. Изомеризация ендиола в слабощелочнной среде. Реакция Лобри де Брюина и Альберда Ван Экенштейна как метод получения труднодоступных кетоз. Дегидратация ендиола в умеренно щелочных средах до дезоксиозулоз с последующей перегруппировкой бензилового типа. Образование метасахариновых, изосахариновых и сахариновых кислот. b - Расщепление ендиола при действии концентрированных растворов щелочей (ретроальдольный распад сахаров). Распад гексоз до глицеринового альдегида, и диоксиацетона с последующим образованием пировиноградного альдегида. Образование D,L - молочной кислоты в результате внутримолекулярной реакции Канниццаро из пировиноградного альдегида.
4.2.4.3. Реакции моносахаридов по гидроксильным группам.
Общая характеристика реакционной способности гидроксильных групп моносахаридов. Образование в ходе реакций по гидроксильным группам смеси производных a- и b- аномеров пиранозной и фуранозной форм моносахаридов вследствие мутаротации последних в растворах.
Реакции моносахаридов как полиолов - образование сахаратов при действии щелочно-земельных и тяжелых металлов.
Реакции полуацетального гидроксила. Образование О-гликозидов. Реакция Фишера. Влияние стереоэлектронных факторов на состав образующихся гликозидов. Устойчивость гликозидов в щелочных средах. Механизм гидролиза гликозидов в кислых средах. Образование N - гликозидов. Перегруппировка Амадори.
4.2.4.4. Фотосинтез
Световая фаза фотосинтеза. Окислительно-восстановительные системы СО2/(СН2О) [φ = − 0.43B] и О2/Н2О [φ = + 0.83B]. Передача электронов и протонов из воды к окислительно-восстановительной системе НАДФ+/НАДФ(Н)+Н+. Фотосистемы I (Р700) и II (Р680) как поставщики энергии, необходимой для переноса электронов против электрохимического градиента. Структура светособирающих пигментов на примере хлорофилла (тетрапиррольный макроцикл с сопряженными двойными связями, содержащий ковалентно связанный йон магния). Пять участков пути переноса электронов: 2 пигментные системы и 3 электронотранспортных цепи.
Нециклическое фотофосфорилирование: перенос электронов, сопровождаемый фосфорилированием АДФ до АТФ.
Темновая фаза фотосинтеза: механизм цикла Кальвина. Три основных типа химических превращений в цикле Кальвина: енолизация с последующей изомеризацией, перенос кетольной группы (СН2ОН–СО-) и конденсация альдольного типа.
Реакция 1 цикла Кальвина (см. приложение): фиксация СО2 молекулой Д-рибулозо-1,5-дифосфата. Енолизация Д-рибулозо-1,5-дифосфата с последующим депротонированием енола, приводящее к енолат-аниону. Карбоксилирование последнего по второму углеродному атому с образованием промежуточной β-кетокислоты: 2-карбокси-3-кето-Д-рибитол-1,5-дифосфата. Гидролитическое расщепление этой кислоты на 2 молекулы Д-3-фосфоглицериновой кислоты (3-ФГК). Фосфорилирование 3-ФГК с помощью АТФ (реакция 2) до 1,3-дифосфоглицериновой кислоты (1,3-ФГК). Восстановление 1,3-ФГК (реакция 3) до 3-фосфоглицеральдегида (3-ФГА) с участием НАДФ(Н).
Четыре направления расходования 3-ФГА в цикле Кальвина:
а) изомеризация 3-ФГА в дигидроксиацетонфосфат (ДГАФ) через енол (реакция 4);
б) конденсация альдольного типа 3-ФГА с ДГАФ (реакция 5) с образованием Д-фруктозо-1,6-дифосфата с последующим дефосфорилиро-ванием до Д-фруктозо-6-фосфата (реакция 6);
с) перенос кетольной группы (СН2ОН–СО-) на 3-ФГА от Д-фруктозо-6-фосфата (реакция 7) в присутствии тиаминпирофосфата (ТПФ) с образованием смеси равных количеств Д-ксилулозо-5-фосфата (Ксу-5-Ф) и Д-эритрозо-4-фосфата (Э-4-Ф). Конденсация альдольного типа Э-4-Ф с ДГАФ (реакция 8) с образованием Д-седогептулозо-1,7-дифосфата (Су-1,7-БФ) с его последующим дефосфорилированием (реакция 9) до Д-седогептулозо-7-фосфата (Су-7-Ф);
д) перенос кетольной группы (СН2ОН–СО-) на 3-ФГА от Су-7-Ф (реакция 10) в присутствии ТПФ с образованием смеси равных количеств Ксу-5-Ф и Д-рибозо-5-фосфата (Р-5-Ф).
Эпимеризация ксилулозо-5-фосфата (образованного по реакциям 7 и 10) по третьему углеродному атому через енол (реакция 11) в Д-рибулозо-5-фосфат (Ру-5-Ф). Изомеризация Д-рибозо-5-фосфата (образованного по реакции 10) через енол (реакция 12) до Ру-5-Ф. Фосфорилирование с помощью АТФ Ру-5-Ф (образованного по реакциям 11 и 12) в исходное соединение цикла Кальвина – Д-рибулозо-1,5-дифосфат (реакция 13).
Стехиометрия реакций в цикле Кальвина.
4.2.5.1. Омыляемые липиды: простые (жиры, масла, воски), сложные (фосфолипиды, сфинголипиды, гликолипиды). Природные животные и растительные жиры как триацилглицерины – сложные эфиры глицерина и высших прямоцепочечных (жирных) карбоновых кислот: насыщенных –миристиновой (С13Н27СООН), пальмитиновой (С15Н31СООН), стеариновой (С17Н35СООН) и ненасыщенных – олеиновой (С17Н33СООН, 18:1 (9Z)), линолевой (С17Н31СООН, 18:2 (9Z,12Z)) и линоленовой (С17Н29СООН, 18:3 (9Z, 12Z, 15Z)).
4.2.5.2. Фосфолипиды как производные фосфатидовых кислот, в которых фосфатная группировка этерифицирована с одной стороны диацилглицерином, с другой стороны – β-этаноламином [HOCH2CH2NH2 (кефалины)], холином [HOCH2CH2N+(CH3)3 (лецитины)], серином [HOCH2CH(NH2)COOH (фосфатидил-серины)]. Наличие одновременно гидрофобных (радикалы жирных кислот) и гидрофильных (фосфат-аминная группировка) участков фосфолипидов как условие образование липидного слоя на границе раздела жидких фаз (вода-липид) и двойного липидного слоя – основы биологических мембран.
4.2.5.3. Биосинтез жирных кислот:
- ацилирование уксусной кислотой кофермента А с образованием ацетилкофермента А,
- конденсация диоксида углерода с ацетилкоферментом А с образованием малонилкофермента А,
- конденсация малонилкофермента А с новой молекулой ацетилкофермента А с последующим декарбоксилированием и образованием ацетоацетилкофермента А и молекулы кофермента А,
- восстановление карбонильной группы в ацетоацетилкоферменте А до гидроксильной с помощью [НАДФ(Н) + Н+],
- дегидратация с образованием S-КоА производного α,β-непредельной карбоновой кислоты,
- гидрирование с помощью [НАДФ(Н) + Н+] с образованием бутирилкофермента А,
- новая конденсация бутирилкофермента А с диоксидом углерода и повторение последующих реакций цикла и т.д. до достижения требуемой длины углеродной цепи.
Биосинтез триацилглицеридов из дигидроксиацетона:
- фосфорилирование дигидроксиацетона по одному гидроксилу с помощью АТФ,
- ацилирование оставшегося гидроксила коферментно связанной жирной кислотой (R-CO-SKoA),
- восстановление карбонильной группы с помощью НАД(Н) до спиртовой с последующим ацилированием коферментно связанной жирной кислотой,
- образовавшаяся фосфатидовая кислота может идти на формирование фосфолипидов или на гидролиз с освобождением третьей спиртовой группы с последующим ее ацилированием.
4.2.5.4. Неомыляемые липиды – низкомолекулярные биорегуляторы – стероиды, жирорастворимые витамины, простагландины.
Стероиды как производные конденсированного четырехциклического остова стерана. Образование стероидов путем эпоксидирования терминальной двойной связи сквалена (30 атомов С) с последующей синхронной многоцентровой циклизацией сквален-оксида в условиях кислотного катализа с образованием ланостерола (30 атомов С), и затем, с потерей 3 атомов С, –холестерола (холестерина) (27 атомов С). Холерин как предшественник желчных кислот, половых гормонов и кортикостероидов.
Холевая и 7-дезоксихолевая кислоты; амиды холевой кислоты с глицином и таурином (NH2CH2CH2SO3H) – глицинхолевая и таурохолевая кислоты, их роль в эмульгировании и переваривании жиров.
Мужские половые гормоны – андростерон и тестостерон. Использование 19-нортестостерона для наращивания мышечной массы. Женские половые гормоны – эстрадиол и прогестерон. Пероральные женские контрацептивы – местранол – на основе структуры женских половых гормонов.
Кортикостероиды: вырабатываемый в коре надпочечников кортикостерон и синтетический – преднизолон.
Простагландины (PG) – оксигенированные производные простановой кислоты, образующейся при мягком окислении арахидоновой и других полиеновых жирных кислот. Классификация простагландинов по характеру оксигенирования циклопентанового кольца: PGA, PGB, PGC, PGD, PGE, PGF, PGH, PGI, PGY. Физиологическая активность простагландинов.
Дыхание как окислительный процесс, в котором углеводы, жиры и другие сложные молекулы расщепляются до СО2 и Н2О, а высвобождаю-щаяся при этом энергия запасается будучи использована для образования АТФ из АДФ и ортофосфата (окислительное фосфорилирование).
4.2.6.1.Катаболизм глюкозы - гликолиз. Ферментативный гидролиз углеводов в организме до глюкозы и фруктозы с последующим превращением последних в пировиноградную кислоту:
I этап: превращения гексоз.
1.Фосфорилирование глюкозы до глюкозо-6-фосфата (расходуется 1 молекула АТФ).
2.Изомеризация глюкозо-6-фосфата в фруктозо-6-фосфат.
3.Фосфорилирование фруктозо-6-фосфата до фруктозо-1,6-дифосфата (расходуется 1 молекула АТФ).
4.Альдольное расщепление фруктозо-1,6-дифосфата до глицеральдегид-3-фосфата и дигидроксиацетонфосфата.
II этап: превращения триоз
(так как из одной молекулы гексозы образуются две молекулы триозы, то в дальнейшем удваиваются стехиометрические коэффициенты в уравнениях).
5.Изомеризация дигидроксиацетонфосфата в глицеральдегид-3-фосфат.
6.Окисление, сопряженное с фосфорилированием глицеральдегид-3-фосфата в 3-фосфоглицероилфосфат в присутствии НАД+ и Н3РО4 [образование 2 молекул НАД(Н)].
7.Гидролиз 3-фосфоглицероилфосфата до 3-фосфоглицерата сопровождаемый образованием 2 молекул АТФ из АДФ.
8.Изомеризация 3-фосфоглицерата в 2-фосфоглицерат.
III этап: превращения оксокарбоновых кислот
9.Дегидратация 2-фосфоглицерата до фосфоенолпирувата.
10.Кислотный гидролиз фосфоенолпирувата в пируват, сопровождаемый образованием 2 молекул АТФ из АДФ.
Окислительное декарбоксилирование образовавшегося пирувата в присутствии НАД+ и кофермента А (HSKOA) с образованием ацетилкофермента А и НАД(Н). Дальнейшее окисление ацетильного остатка ацетилкофермента А до СО2 и Н2О в цикле Кребса (на 1молекулу глюкозы в итоге образуется 38 молекул АТФ).
4.2.6.2.Катаболизм жирных кислот - β-Окисление жирных кислот до ацетилкофермента А (жирные кислоты участвуют в цикле в виде производных кофермента А):
- дегидрирование по α- и β- углеродным атомам при участии окисленной формы кофермента ФАД с образованием транс – изомера α,β-непредельной карбоновой кислоты,
- гидратация с образованием оптического L – изомера β- гидроксикарбоновой кислоты,
- окисление гидроксильной группы до карбонильной при участии окисленной формы кофермента НАД+,
- β-расщепление, осуществляемое путем нуклеофильной атаки кофермента А на карбонильный углерод с последующим отщеплением ацетилкофермента А и циклы повторяются вплоть до полного расщепления углеродной цепи на двухуглеродные фрагменты.
4.2.6.3.Общий этап для катаболизма углеводов и жиров: реакции цикла Кребса (цикл лимонной кислоты или ди- и трикарбоновых кислот) - окисление ацетилкофермента А до диоксида углерода и воды:
- нуклеофильное присоединение ацетилкофермента А по карбонильной группе оксалоацетата с последующим гидролизом тиоэфирной связи, отщеплением кофермента А и образованием цитрата,
- изомеризация цитрата в изоцитрат за счет двух последовательных реакций: дегидратации исходного цитрата и гидратации образующегося промежуточного соединения,
- дегидрирование (окисление) изоцитрата с помощью НАД+ с образованием оксалосукцината,
- декарбоксилирование оксалосукцината в 2 – оксоглутарат,
- окислительное декарбоксилирование 2 – оксоглутарата, происходящее под действием НАД+ и HSKoA – как завершающий этап окисления ацетильного остатка ацетилкофермента А до СО2 и Н2О,
- гидролиз сукцинилкофермента А с высвобождением HSKoA и сопряженным синтезом одной молекулы АТФ,
- дегидрирование сукцината в фумарат с помощью окисленной формы кофермента ФАД,
- стереоспецифическое присоединение воды по двойной связи фумарата с образованием L – малата,
- регенерация оксалоацетата за счет дегидрирования L – малата.
Повторение цикла трикарбоновых кислот реакцией оксалоацетата с новой молекулой ацетилкофермента А.
|
|
|
|
|
Дата добавления: 2015-06-30; Просмотров: 1240; Нарушение авторских прав?; Мы поможем в написании вашей работы!