
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Буферные системы крови
|
|
|
|
Кровь способна противодействовать изменению рН при увеличении концентрации Н+ или щелочных ионов, т.е. поддерживать постоянство значения своего рН, которое в норме колеблется от 7,37 до 7,44. Снижение величины рН ниже 6,8 или возрастание до 8,0 несовместимые с жизнью, в клинике практически не встречаются. Кровь представляет собой взвесь клеток в жидкой среде, поэтому ее кислотно-основное равновесие поддерживается совместным участием буферных систем плазмы и клеток крови.
Такие системы состоят из слабой кислоты и ее соли с сильным основанием или слабого основания с солью сильной кислоты. Важнейшими буферными системами крови являются бикарбонатная, фосфатная, белковая и наиболее мощная гемоглобиновая.
Бикарбонатная буферная система - с амая управляемая система внеклеточной жидкости: на ее долю приходится около 10% всей буферной емкости крови. В данной системе донором протонов является Н2СО3, а акцептором бикарбонат-ион НСО3-.
При выделении в кровь больших количеств кислых продуктов, водородные ионы Н+ взаимодействуют с НСО3- образуя Н2СО3, которая выделяет СО2 через легкие в результате их гипервентиляции. Если в крови увеличивается количество оснований, то они взаимодействуют со слабой угольной кислотой, образуя ионы бикарбонатов и воду. При этих взаимодействиях не происходит заметных сдвигов в величине рН и в плазме задерживается некоторое количество СО2 в результате гиповентиляции легких. Данная буферная система тесно связана с гемоглобиновой системой, которая в 9 раз мощнее бикарбонатного буфера и составляет 75% всей буферной емкости крови.
Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и углекислого газа. Диссоциация кислотных групп гемоглобина меняется от его насыщения кислородом (ННbO2 более сильная кислота, нежели HHb). В паре с ними работают их соли KHbO2 и KHb, выполняющие функции сопряженных оснований. Системы гемоглобина и оксигемоглобина являются взаимопревращающимися и существуют как единое целое. Кислые соединения реагируют с калиевой солью гемоглобина: KHb + H2CO3 ® KHCO3 + HHb, что поддерживает рН крови в пределах допустимых величин. В капиллярах легких HHbO2 подкисляет кровь и понижает щелочной резерв.
Белковая буферная система имеет меньшее значение для поддержания кислотно-основного равновесия (14%) в плазме крови, чем другие буферные системы. Благодаря наличию кислотно-основных групп (-СОО- и -N+H3) она может быть донором протонов и их акцептором, в результате чего эффективна в области значений рН 7,2-7,4.
Фосфатная буферная система составляет 1% от буферной системы крови и представляет собой сопряженную кислотно-основную пару Н2РО4- (донор протонов) и НРО 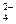 (акцептор протонов). В крови соотношение [НРО
(акцептор протонов). В крови соотношение [НРО 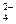 ]:[Н2РО4-] составляет 4:1 и ее максимальная буферная емкость проявляется вблизи рН 7,2. Органические фосфаты также обладает буферной емкостью, но мощность их слабее.
]:[Н2РО4-] составляет 4:1 и ее максимальная буферная емкость проявляется вблизи рН 7,2. Органические фосфаты также обладает буферной емкостью, но мощность их слабее.
Нарушения кислотно-основного равновесия (КОР)
Если компенсаторные механизмы организма не могут предотвратить сдвиги концентрации водородных ионов, то КОР нарушается и могут наблюдаться два противоположных состояния – ацидоз и алкалоз.
При ацидозе рН крови уменьшается и ниже 6,8 – вызывает смерть, если рН возрастает до 8, то такое состояние также не совместимо с жизнью.
В зависимости от механизмов развития нарушений КОР, выделяют дыхательный и метаболический ацидоз (или алкалоз).
Дыхательный ацидоз возникает в результате гиповентиляции легких при уменьшении объема дыхания (астма, эмфизема, отек легких), что ведет к накоплению СО2 и Н2СО3 в плазме (гиперкапния). рН крови снижается и повышается выведение с мочой свободных кислот или их аммонийных солей.
Метаболический ацидоз - частая и тяжелая форма нарушения КОР, обусловлен накоплением в тканях органических кислот (лактата или кетоновых тел). Такое возможно при голодании, лихорадке и особенно при диабете при недостаче инсулина. Метаболический ацидоз ведет к компенсаторному выделению СО2 в бикарбонатной системе, а это в свою очередь ведет к понижению и [НСО3-], что ведет к неблагоприятным последствиям.
Дыхательный алкалоз возникает при резко усиленной вентиляции легких, сопровождающейся быстрым выделением из организма СО2 и развитием гипокапнии (понижение парциального давления углекислого газа в крови). Данный вид алкалоза наблюдается при вдыхании чистого кислорода, пребывание в разреженной атмосфере, при возбуждении дыхательного центра барбитуратами и т.п. За несколько минут внеклеточная жидкость может иметь значение рН до 7,65 и при этом снижается щелочной резерв крови ввиду превращения НСО3- в Н2СО3.
Метаболический алкалоз развивается при потере большого количества кислых эквивалентов (неукротимая рвота, всасывание основных эквивалентов кишечного сока и накопление основных эквивалентов в тканях). При метаболическом алкалозе повышается концентрация НСО3- в плазме, компенсирующая урежением частоты дыхания с задержкой СО2. Кислотность мочи и содержание NH3 в ней понижены.
В клинической практике специальными приборами измеряют рН, РСО2 (парциальное давление углекислого газа) и концентрацию бикарбоната в плазме. Норма [НСО3-] = 25 ммоль/л, РСО2 = 53,3 гПа (40 мм рт.ст.), [Н2СО3-] = 0,625 мл/л.
ЛАБОРАТОРНЫЕ ЗАНЯТИЯ ПО БИОХИМИИ КРОВИ
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 826; Нарушение авторских прав?; Мы поможем в написании вашей работы!