
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Единицы количества вещества
|
|
|
|
Единицы количества вещества и способы выражения концентрации
П р е д в а р и т е л ь н ы е з а м е ч а н и я
Дополнительная литература
Основная литература
Л и т е р а т у р а
| Основные источники информации | Рекомендуемые сайты для скачивания литературы |
| 4.1.1.Копылов А.С., Лавыгин В.М., Очков В.Ф. Водоподготовка в энергетике.- М.:Изд.: МЭИ. 2006.-310 с. | ПРО-инженер [Электронный ресурс]: учебная и техническая литература для студентов и проектировщиков/ Про-Инженер. Технические книги и справочники.-Электрон.дан. – 2012 – Режим доступа: WWW.proingener.ru, свободный |
| 4.1.2. Гужулев Э.П., Шалай В.В., Гриценко В.И., Таран М.А. Водоподготовка и водно-химические режимы в теплоэнергетике: Учебное пособие. Омск: Изд-во ОмГТУ, 2005. _384 с. |
| Дополнительные источники информации | Рекомендуемыйсайт для скачивания литературы |
| 4.2.1.Фрог Б.Н., Левченко А.П. Водоподготовка. Учебн. пособие для вузов. –М.: Изд.: МГУ. 1996.-680 с. | ПРО-инженер [Электронный ресурс]: учебная и техническая литература для студентов и проектировщиков/ Про-Инженер. Технические книги и справочники.-Электрон.дан. – 2012 – Режим доступа: WWW.proingener.ru, свободный |
| 4.2.2 Кострикин Ю.М., Мещерский Н.А., Коровина О.В. Водоподготовка и водный режим энергообъектов низкого и среднего давления: Справочник. М.: ЭНЕРГОАТОМИЗДАТ. 1990. 252 с. | |
| 4.2.3.Водоподготовка: Процессы и аппараты. // Под ред. О.И.Мартыновой. – М.: Энергоатомиздат. 1990. – 272 с. | |
| 4.2.4.Белан Ф.И. Водоподготовка: расчеты, примеры, задачи. – М.: Энергия. 1978. – 256 с. | |
| 4.2.5. Рябчиков Б.Е. Современные методы подготовки воды для промышленного и бытового использования.- М.: ДеЛи принт. 2004.- 301 с. | |
| 4.2.6 ОСТ 34-7-953 Воды производственные тепловых электростанций. | |
| 4.2.7 РД-34.37.506-88 Методические указания по водоподготовке. | |
| 4.2.8 Методические указания и задания для самостоятельной работы (электронная версия). НХТИ, г. Нижнекамск. 2011г. |
Для решения практических задач по водоподготовке необходимо знать способы выражения концентраций, регламентируемые международной системой (Systeme International - SI, в русской транскрипции СИ). Ниже рассматриваются наиболее часто встречающиеся их наименования, обозначения, а также множители и приставки для образования десятичных кратных и дольных единиц, применяемых в практике аналитического контроля исходной и очищенной воды, а также водного конденсата.
Моль (n). За единицу количества вещества принят один моль. Это такое количество вещества, которое содержит столько условных частиц, сколько атомов содержится в 0,012 кг углерода-12, т.е. 6,02045 ·1023 (постоянная Авогадро NA).
Условной частицей может быть ион, молекула, электрон, группы частиц. Одни условные частицы существуют реально (молекула), другие чисто условно (молекула NaClв растворе, половина молекулы). Единица моль условных частиц удобна и обычно используется для выражения количества микрообъектов. Запись n(1/5KMnO4) = 0,05 моль означает 6,02045·1023·0,05 условных частиц 1/5 KMnO4.
Молярная масса (M) – это масса 1 моль вещества. Если имеется вещество массой m, то М=m/n, где n - количество вещества. Размерность молярной массы г/моль.
Численно молярная масса равна относительной молекулярной массе т.е. суммарной массе всех атомов в частице. Относительная молекулярная масса — безразмерная величина.
Пример. Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
Решение. Молярная масса оксида серы SO3 составляет:
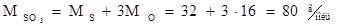
Определяем количество вещества SO3:
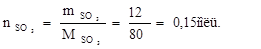
Молярный объем (Vo) – это объем одного моль вещества при нормальных условиях. Обычно эту величину используют для газов, в этом случае Vо = 22,4 дм3/моль.
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 625; Нарушение авторских прав?; Мы поможем в написании вашей работы!