
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение. Расчет активности (эффективной концентрации) ионов в водных растворах и его применение при прогнозировании эффективности обработки воды
|
|
|
|
Краткое содержание.
Расчет активности (эффективной концентрации) ионов в водных растворах и его применение при прогнозировании эффективности обработки воды.
Под активной концентрацией того или иного иона понимают действующую (эффективную концентрацию ai, моль/дм3, которая пропорциональна количеству вещества (иона) сi, находящегося в растворе:
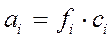
Коэффициент активности fi зависит не только от ci, но и от концентрации других ионов, присутствующих в растворе. Суммарное влияние на fi всех ионов характеризуется ионной силой раствора Ii , определяемой по формуле

где c – молярная или моляльная концентрация иона, моль/дм3 , моль/кг;
z – формальный заряд ионов.
Для абсолютного большинства природных вод 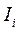 можно определить по эмпирической формуле
можно определить по эмпирической формуле

где S – солесодержание воды, мг/кг.
Зная ионную силу вычисляют или находят по таблице коэффициент активности, который характеризует неидеальность реального раствора. С уменьшением концентрации растворенного вещества его коэффициент активности приближается к единице, так как уменьшаются процессы гидратации, сольватации, комплексообразования, ионной ассоциации. Коэффициент активности это -отношение активности частицы к ее аналитической концентрации (обозначают символами - f, γ, y, для случаев выраженияконцентрации, соответственно, как молярная доля, моляльная концентрация, молярная концентрация (ниже будет использован символ - γ).
Для разбавленных водных растворов, для которых 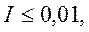 можно определить коэффициент активности γi пользуясь выражением
можно определить коэффициент активности γi пользуясь выражением
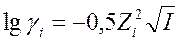
Приближенные значения γ в зависимости от ионной силыприведены в справочниках (см. Ю.Лурье. Справочник аналитической химии).
Коэффициенты активности ионов следует учитывать при вычислениях произведения растворимости (ПР), определении рН растворов и др. (рН – это отрицательный логарифм концентрации водородных ионов, т.е.
рН = -lg[H+]. Аналогично рОН = -lg[ОH-]. Из ионного произведения воды рН + рОН = 14).
Прим е р 1
Оборотная система охлаждения конденсаторов турбин электростанции должна подпитываться водой следующего состава, ммоль/дм3:
| Молярные концентрации ионов, ммоль/дм3 | |||||
| с(1/2Са2+) | с(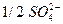 ) )
| с(1/2Mg2+) | с(Сl-) | с(Nа+) | с(HCO3-) |
| 2,5 | 2,5 |
z(SO4)=2; z(Mg)=2; z(Na)=1; z(Cl)= 1; z(Ca)=2; z(HCO3)=1;
Система будет работать с коэффициентом упаривания 1,7.
Температура воды 298 К.
Для предотвращения накипеобразования добавляемую воду предполагается обрабатывать H2SO4 понижая щелочность с 5 до 2 ммоль/дм3
Определить будет ли при этом выпадать в системе гипс (CaSO4  2H2O).
2H2O).
Выпадение осадка происходит, если произведение концентраций катиона и аниона превышает значения ПР.
ПР CaSO4 = c(Ca) · c(SO4)
Произведение растворимости CaSO4 при 298 K равно
ПР CaSO4 =3,7 ·10-5
Для воды указанного состава:
-молярная концентрация ионов Ca2+ в оборотной воде равна, моль/дм3
c1 (Са2+)= 
с учетом коэффициента упаривания, (с2), моль/дм3
 ;
;
-молярная концентрация сульфат-ионов С1(SO  ) в оборотной воде равна, моль/дм3
) в оборотной воде равна, моль/дм3
c1 (SO  )=
)= 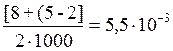
С учетом коэффициента упаривания, (c2 (SO  ), моль/дм3
), моль/дм3
с2 (SO  )=
)= 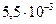
 =
= 

Тогда с2(SO  )·
)· 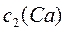 =·9,35·10-3 · 8,5·10-3 =7,948·10-5
=·9,35·10-3 · 8,5·10-3 =7,948·10-5
7,95·10-5 > 3,7 ·10-5
т.е. выпадение CaSO4 в осадок в циркуляционной системе окажется возможным (образуется гипс).
Для подтверждения этого произведем более точный расчет, используя активные концентрации ионов Ca2+ и  .
.
Ионная сила (I) данного раствора равна полусумме произведений концентраций ионов, присутствующих в растворе (С), на квадрат их заряда z.
Необходимые для расчета исходные данные представим в виде таблицы.
| Молярные концентрации эквивалентов ионов, ммоль/дм3 | |||||
| с(1/2Са2+) =10 | с(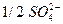 ) = = 8 + 3 =11 ) = = 8 + 3 =11
| с(1/2Mg2+)= 2,5 | с(Сl-) = 2,5 | с(Nа+) = 3 | с(HCO3-) = 5 |
| Молярные концентрации ионов (с учетом указанных значений z), ммоль/дм3 | |||||
| с(Са2+) =5 | с(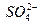 ) = 5,5 ) = 5,5
| с(Mg2+)= 1,25 | с(Сl-) = 2,5 | с(Nа+) = 3 | с(HCO3-) = 5 |
| Молярные концентрации ионов с учетом коэффициента упаривания, ммоль/дм3 | |||||
| 8,5 | 9,35 | 2,13 | 4,25 | 5,1 | 8,5 |
| Формальные заряды ионов, (z) | |||||
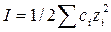 =1/2 ·10-3 [c1(Ca2+)·z2(Ca2+)+c1(SO42-)·z2(SO42-)+c1(Mg2+)·z2(Mg2+) + c1(Сl)·z2(Сl) + c1(Na+)·z2(Na+) + c1(HСО3)·z2(HСО3)] = ½·10-3 (8,5·22 + 9,35·22 + 2,13·22 + 4,25·12+ +5,1·12 + 8,55·12 = 0,049
=1/2 ·10-3 [c1(Ca2+)·z2(Ca2+)+c1(SO42-)·z2(SO42-)+c1(Mg2+)·z2(Mg2+) + c1(Сl)·z2(Сl) + c1(Na+)·z2(Na+) + c1(HСО3)·z2(HСО3)] = ½·10-3 (8,5·22 + 9,35·22 + 2,13·22 + 4,25·12+ +5,1·12 + 8,55·12 = 0,049
Коэффициенты активности (f) ионов Ca2+ и Mg2+ (табличные значения для вычисленного значения ионной силы, (стр 104, Ю.Лурье Справочник аналитической химии)
f =0,5
Тогда произведение концентрации ионов с учетом их активности равна f2 · с 2(SO  )·
)·  =0,25 · 8,5·10-3 ·9,35·10-3 =19,86·10-6=1,99·10-5
=0,25 · 8,5·10-3 ·9,35·10-3 =19,86·10-6=1,99·10-5
1,99·10-5 < 3,7 ·10-5
Таким образом, обработка данной воды подкислением H2SO4 допустима. Образование гипса не произойдет.
 |
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 1563; Нарушение авторских прав?; Мы поможем в написании вашей работы!