
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач. Пример 1. Определить молярную массу М углекислого газа СО2
|
|
|
|
Пример 1. Определить молярную массу М углекислого газа СО2.
Решение. Молярную массу данного вещества можно определить по формуле
M= M rk, (1) где M r — относительная молекулярная масса вещества; k=10-3 кг/моль.
Относительную молекулярную массу найдем из соотношения
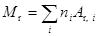 , (2)
, (2)
где пi — число атомов i -го химического элемента, входящих в молекулу данного вещества; A r, i — относительная атомная масса i -го химического элемента.
В нашем случае для углекислого газа формула (2) примет вид
M r =n C A r,C +n O A r,O (3) где n C=1 (число атомов углерода в молекуле углекислого газа); n O=2 (число атомов кислорода в той же формуле); A r,C и A r,O — относительные атомные массы углерода и кислорода.
По таблице Д. И. Менделеева найдем
A r,C=12, A r,O=16.
После подстановки в формулу (3) значений n C, n O, A r,C, и A r,Oполучим
M r = 1×12+2×16=44.
Подставив это значение относительной молекулярной массы, а также значение k в формулу (1), найдем молярную массу углекислого газа:
M =44×10-3 кг/моль =4,4×10-2 кг/моль.
Пример 2. Найти молярную массу М смеси кислорода массой m1=25 г и азота массой m2=75 г.
Решение. Молярная масса смеси М см есть отношение массы смеси т см к количеству вещества смеси v см т. е.
M см=mсм/ v см. (1)
Масса смеси равна сумме масс компонентов смеси mсм=m1+m2. Количество вещества смеси равно сумме количеств вещества компонентов.
Подставив в формулу (1) выражения mсм и v см, получим
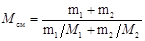
Применив способ, использованный в примере 1, найдем молярные массы M 1 кислорода и М 2, азота:
M 1 =32×10-3 кг/моль, М 2=28×10-3 кг/моль. Подставим значения величин во (2) и произведем вычисления:
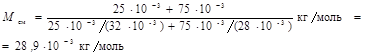
Пример 3. Определить: 1) число N молекул воды, занимающей при температуре t = 4°C объем V= 1 мм3; 2) массу m1 молекулы воды; 3) диаметр d молекулы воды, считая, что молекулы имеют форму шариков, соприкасающихся друг с другом.
Решение. 1. Число N молекул, содержащихся в теле некоторой массы m, равно произведению постоянной Авогадро n a на количество вещества v: n = n a v. Так как v =m/ M, где М — молярная масса, то N=( m /M)n a. Выразив в этой формуле массу как произведение плотности r на объем V, получим
N=( rV /M) n a. (1)
Все величины, кроме молярной массы воды, входящие в (1), известны: r=l×103 кг/м (см. табл. 9), V=1 мм3=1×10-9, n a=6,02×1023 моль-1 (см. табл. 24).
Зная химическую формулу воды (Н2О), найдем молярную массу воды (см. пример 1):
M= M rk = (2×1+1×16)×10-3 кг/моль=18×10-3 кг/моль. Подставим значения величин в (1) и произведем вычисления:
N= [1×103×1×10-9/(18×10-3)] 6,02×1023 молекул=3,34.1019 молекул.
2. Массу одной молекулы воды найдем делением ее молярной массы на постоянную Авогадро: m1= M / n a Произведя вычисления по этой формуле, получим
 .
.
3. Будем считать, что молекулы плотно прилегают друг к другу, тогда на каждую молекулу диаметром d приходится объем (кубическая ячейка) V1= d 3. Отсюда
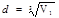 . (1)
. (1)
Объем V1 найдем, разделив молярный объем Vm вещества на число молекул в моле, т. е.на постоянную Авогадро n a: V1= Vm/ n a. Молярный объем равен отношению молярной массы к плотности вещества, т. е. Vm= M /r Поэтому можем записать, что V1=M/(r n a).Подставив полученное выражение V1 в формулу (1),
получим
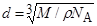 . (2) Проверим, дает ли правая часть выражения (2) единицу длины:
. (2) Проверим, дает ли правая часть выражения (2) единицу длины:
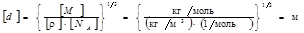
Теперь подставим значения величин в формулу (2) и произведем вычисления:
d =3,ll×10-10 м=311 пм.
Пример 4. В баллоне объемом V= 10 л находится гелий под давлением r1=l МПа при температуре T 1=300 К. После того как из баллона был израсходован гелий массой m=10 г, температура в баллоне понизилась до T 2=290 К. Определить давление r2 гелия, оставшегося в баллоне.
Решение. Для решения задачи воспользуемся уравнением Клапейрона — Менделеева, применив его дважды к начальному и конечному состояниям газа. Для начального состояния уравнение имеет вид
p 1V(m1/ M)R T 1, (1) а для конечного состояния —
p 2V(m2/ M)R T 2, (2) где m1 и m2 — массы гелия в начальном и конечном состояниях.
Выразим массы m1 и m2 гелия из уравнений (1) и (2):
m1= Mp1V /(R T 1); (3)
m2= Mp2V /(R T 2); (4)
Вычитая из (3) равенство (4), получим
 .
.
Отсюда найдем искомое давление:
 .
.
Проверим, дает ли правая часть формулы (5) единицу давления. Для этого выразим все величины, входящие в нее, в соответствующих единицах. Единица, в которой выражается первое слагаемое, не вызывает сомнений, так как отношение T2/T1 — величина безразмерная. Проверим, в каких единицах выражается второе слагаемое:

Убедившись в том, что правая часть полученной расчетной формулы дает единицу искомой величины—давления, можем подставить в (5) значения всех величин и произвести вычисления.
В формуле (5) все величины, кроме молярной массы М гелия, известны. Найдем ее (см. пример 1). Для гелия как одноатомного
газа относительная молекулярная масса равна его относительной атомной массе Аr.
Из таблицы Д. И. Менделеева найдем Аr=4. Следовательно, молярная масса гелия М= Аr×10-3 кг/моль =4×10-3 кг/моль. Подставив значения величин в (5), получим
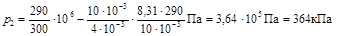 .
.
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 960; Нарушение авторских прав?; Мы поможем в написании вашей работы!