
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Запишите уравнения процессов, идущих на аноде и катоде и уравнение токообразующей реакции (ТОР) при работе Вашего ГЭ
|
|
|
|
Примеры решения задач.
ЗАДАЧА 1.
1. На основании стандартных электродных потенциалов определите, какой из двух электродов в ГЭ будет анодом и какой катодом? Почему?
Дан гальванический элемент (ГЭ) Cl2/Cu
Е 0 Cl2 /Cl -= +1,359 В.
Е 0 Cu 2 +/Cu = +0,337 В
В гальваническом элементе катод – электрод с более положительным значением равновесного потенциала, анод – электрод с более отрицательным значением равновесного потенциала. Значение стандартных потенциалов хлорного электрода и медного электрода приведены выше.
Делаю вывод, что хлорный электрод-катод, медный электрод-анод..
Уравнения процессов, протекающих на аноде и катоде в работающем Cu/Cl2 ГЭ и уравнение токообразующей реакции:
А: Cu → Cu2+ + 2е - окисление
К: Cl2 + 2е → 2Cl- - восстановление
ТОР: Cu + Cl2 → Cu2+ + 2Cl -
3. Рассчитайте ЭДС (Е0 Э) и максимальную электрическую работу (W) ГЭ при с.с. и 298 К.
D f G 0Cu2 = 65,03 кДж/моль; D f G 0 Cl- = -131,17 кДж/моль;
D f G 0 Cu= 0; D f G 0 Cl2 = 0
по закону Гесса, рассчитаем энергию Гиббса и ЭДС данного элемента при с.с. и 298 К:
D G 0ТОР = D f G 0Cu2 + 2D f G 0 Cl- - D f G 0 Cu - D f G 0 Cl2 =
= 65,03+ 2. (-131,17) - 0 - 0 = -197,31 кДж.
Е 0Э = - D G 0ТОР / nF = - (-197310)/ (2. 96500) = 1,022 B.
или Е 0Э= Е 0К - Е 0А = Е 0 Cl2 /Cl - - Е 0 Cu2+/Cu = 1,359- 0,337 = 1,022 В.
Максимальная электрическая работа гальванического элемента при с.с.
и 298 К:
W = - D G 0ТОР = 197,31 кДж.
4. Рассчитайте ЭДС (Е Э) и максимальную электрическую работу
(W) Вашего ГЭ при уменьшении активности потенциалопределяющих ионов анода (a i) в 100 раз (активность ионов катода и парциальное давление газов считать стандартными, Т =298 К).
Рассчитаем ЭДС гальванического элемента Cu/Cl2 по уравнению Нернста
при 298 К; стандартном состоянии катода (Cl2 /Cl - - электрода,
 Cl2= 105 Па/105 Па = 1, а Cl- = 1 моль/л);
Cl2= 105 Па/105 Па = 1, а Cl- = 1 моль/л);
при уменьшении активности потенциалопределяющих ионов анода (Cu2+/Cu - электрода) в 100 раз, т.е. а Cu2+ =0,01 моль/л:
Е Э = 1,022 + 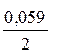 lg
lg 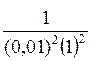 = 1,022+ 0,118 = 1,14В.
= 1,022+ 0,118 = 1,14В.
Максимальная электрическая работа ГЭ при этих условиях:
W = - D G ТОР = Е Э . nF = 1,14.2.96500=74112 Дж=220084 кДж.
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 2603; Нарушение авторских прав?; Мы поможем в написании вашей работы!