
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хлориды
|
|
|
|
Хлорид натрия NaCl. Бескислородная соль. Бытовое название поваренная соль. Белый, слабогигроскопичный. Плавится и кипит без разложения. Умеренно растворим в воде, растворимость мало зависит от температуры, раствор имеет характерный соленый вкус. Гидролизу не подвергается. Слабый восстановитель. Вступает в реакции ионного обмена. Подвергается электролизу в расплаве и растворе.
Применяется для получения водорода, натрия и хлора, соды, едкого натра и хлороводорода, как компонент охлаждающих смесей, пищевой продукт и консервирующее средство.
В природе – основная часть залежей каменной соли, или галита, и сильвинита (вместе с КCl), рапы соляных озер, минеральных примесей морской воды (содержание NaCl = 2,7 %). В промышленности получают выпариванием природных рассолов.
Уравнения важнейших реакций:
2NaCl(т) + 2H2SO4 (конц.) + MnO2(т) = Cl2↑ + MnSO4 + 2Н2O + Na2SO4 (100 °C)
10NaCl(т) + 8H2SO4 (конц.) + 2КMnO4(т) = 5Cl2↑ + 2MnSO4 + 8Н2O + 5Na2SO4 + K2SO4 (100 °C)
6NaCl(т) + 7H2SO4 (конц.) + К2Cr2O7(т) = ЗCl2 + Cr2(SO4)3 + 7Н2O + 3Na2SO4 + K2SO4 (100 °C)
2NaCl(т) + 4H2SO4 (конц.) + РЬO2(т) = Cl2↑ + Pb(HSO4)2 + 2Н2O + 2NaHSO4 (50 °C)
NaCl (разб.) + AgNO3 = NaNO3 + AgCl↓
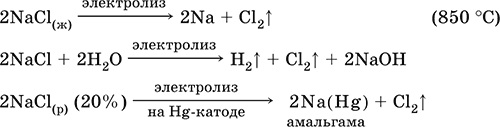
Хлорид калия KCl. Бескислородная соль. Белый, негигроскопичный. Плавится и кипит без разложения. Умеренно растворим в воде, раствор имеет горький вкус, гидролиза нет. Вступает в реакции ионного обмена. Применяется как калийное удобрение, для получения К, КОН и Cl2. В природе основная составная часть (наравне с NaCl) залежей сильвинита.
Уравнения важнейших реакций одинаковы с таковыми для NaCl.
Хлорид кальция СаCl2. Бескислородная соль. Белый, плавится без разложения. Расплывается на воздухе за счет энергичного поглощения влаги. Образует кристаллогидрат СаCl2 6Н2O с температурой обезвоживания 260 °C. Хорошо растворим в воде, гидролиза нет. Вступает в реакции ионного обмена. Применяется для осушения газов и жидкостей, приготовления охлаждающих смесей. Компонент природных вод, составная часть их «постоянной» жесткости.
Уравнения важнейших реакций:
СаCl2(т) + 2H2SO4 (конц.) = Ca(HSO4)2 + 2НCl↑ (50 °C)
СаCl2(т) + H2SO4 (конц.) = CaSO4↓ + 2НCl↑ (100 °C)
СаCl2 + 2NaOH (конц.) = Ca(OH)2↓ + 2NaCl↑
ЗСаCl2 + 2Na3PO4 = Са3(РO4)2↓ + 6NaCl
СаCl2 + К2СO3 = СаСO3↓ + 2КCl
СаCl2 + 2NaF = CaF2↓ + 2NaCl
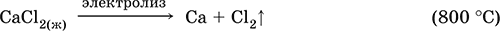
Получение:
СаСO3 + 2HCl = СаCl2 + СO3↑ + Н2O
Хлорид алюминия AlCl3. Бескислородная соль. Белый, легкоплавкий, сильнолетучий. В паре состоит из ковалентных мономеров AlCl3 (треугольное строение, sр2‑гибридизация, преобладают при 440–800 °C) и димеров Al2Cl6 (точнее, Cl2AlCl2AlCl2, строение – два тетраэдра с общим ребром, sр3‑гибридизация, преобладают при 183–440 °C). Гигроскопичен, на воздухе «дымит». Образует кристаллогидрат, разлагающийся при нагревании. Хорошо растворим в воде (с сильным экзо ‑эффектом), полностью диссоциирует на ионы, создает в растворе сильнокислотную среду вследствие гидролиза. Реагирует со щелочами, гидратом аммиака. Восстанавливается при электролизе расплава. Вступает в реакции ионного обмена.
Качественная реакция на ион Al3+ – образование осадка AlРO4, который переводится в раствор концентрированной серной кислотой.
Применяется как сырье в производстве алюминия, катализатор в органическом синтезе и при крекинге нефти, переносчик хлора в органических реакциях. Уравнения важнейших реакций:
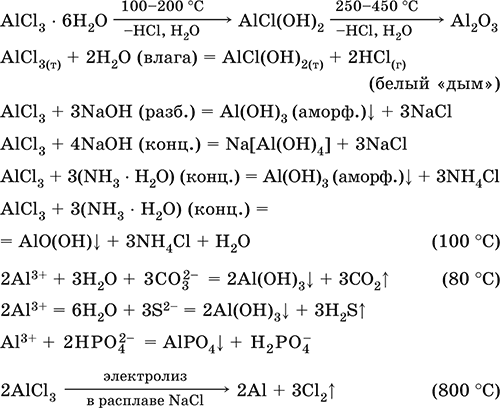
Получение AlCl3 в промышленности – хлорирование каолина, глинозёма или боксита в присутствии кокса:
Al2O3 + ЗС (кокс) + ЗCl2 = 2AlCl3 + ЗСО (900 °C)
Хлорид железа(Н) FeCl2. Бескислородная соль. Белый (гидрат голубовато‑зеленый), гигроскопичный. Плавится и кипит без разложения. При сильном нагревании летуч в потоке HCl. Связи Fe – Cl преимущественно ковалентные, пар состоит из мономеров FeCl2 (линейное строение, sp‑гибридизация) и димеров Fe2Cl4. Чувствителен к кислороду воздуха (темнеет). Хорошо растворим в воде (с сильным экзо ‑эффектом), полностью диссоциирует на ионы, слабо гидролизуется по катиону. При кипячении раствора разлагается. Реагирует с кислотами, щелочами, гидратом аммиака. Типичный восстановитель. Вступает в реакции ионного обмена и комплексообразования.
Применяется для синтеза FeCl3 и Fe2O3, как катализатор в органическом синтезе, компонент лекарственных средств против анемии.
Уравнения важнейших реакций:
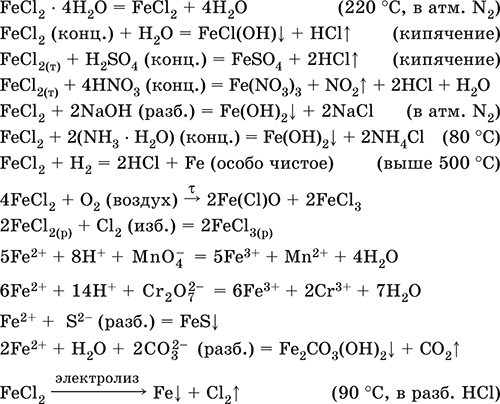
Получение: взаимодействие Fe с соляной кислотой:
Fe + 2НCl = FeCl2 + Н2↑
(в промышленности используют хлороводород и ведут процесс при 500 °C).
Хлорид железа(III) FeCl3. Бескислородная соль. Черно‑коричневый (темно‑красный в проходящем свете, зеленый в отраженном), гидрат темно‑желтый. При плавлении переходит в красную жидкость. Весьма летуч, при сильном нагревании разлагается. Связи Fe – Cl преимущественно ковалентные. Пар состоит из мономеров FeCl3 (треугольное строение, sр2‑гибридизация, преобладают выше 750 °C) и димеров Fe2Cl6 (точнее, Cl2FeCl2FeCl2, строение – два тетраэдра с общим ребром, sр3‑гибридизация, преобладают при 316–750 °C). Кристаллогидрат FeCl3 6Н2O имеет строение [Fe(H2O)4Cl2]Cl • 2Н2O. Хорошо растворим в воде, раствор окрашен в желтый цвет; сильно гидролизован по катиону. Разлагается в горячей воде, реагирует со щелочами. Слабый окислитель и восстановитель.
Применяется как хлорагент, катализатор в органическом синтезе, протрава при крашении тканей, коагулянт при очистке питьевой воды, травитель медных пластин в гальванопластике, компонент кровоостанавливающих препаратов.
Уравнения важнейших реакций:
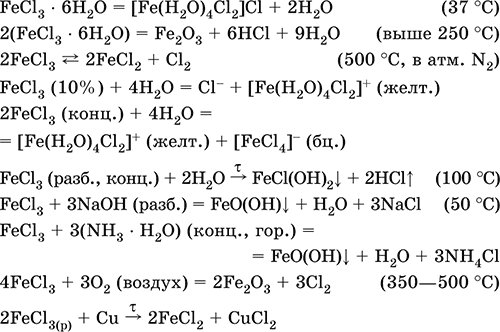
Хлорид аммония NH4Cl. Бескислородная соль, техническое название нашатырь. Белый, летучий, термически неустойчивый. Хорошо растворим в воде (с заметным эндо ‑эффектом, Q = ‑16 кДж), гидролизуется по катиону. Разлагается щелочами при кипячении раствора, переводит в раствор магний и гидроксид магния. Вступает в реакцию конмутации с нитратами.
Качественная реакция на ион NH4+ – выделение NH3 при кипячении со щелочами или при нагревании с гашёной известью.
Применяется в неорганическом синтезе, в частности для создания слабокислотной среды, как компонент азотных удобрений, сухих гальванических элементов, при пайке медных и лужении стальных изделий.
Уравнения важнейших реакций:
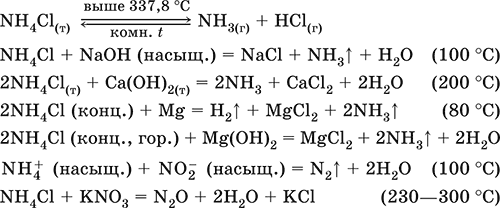
Получение: взаимодействие NH3 с HCl в газовой фазе или NH3 Н2O с HCl в растворе.
|
|
|
|
|
Дата добавления: 2015-06-27; Просмотров: 645; Нарушение авторских прав?; Мы поможем в написании вашей работы!