
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тепловой эффект химической реакции
|
|
|
|
С температурой. Уравнение Кирхгофа.
 ,
,
зависит от температуры. Чтобы найти эту зависимость, рассмотрим реакцию при постоянном давлении, когда
 ,
,
где 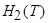 - энтальпия продуктов реакции,
- энтальпия продуктов реакции,  - энтальпия исходных веществ. Для идеальных газов
- энтальпия исходных веществ. Для идеальных газов
 , (2.2.11)
, (2.2.11)
 ,
,
где  ,
,  - мольные теплоемкости реагирующих веществ и продуктов реакции соответственно;
- мольные теплоемкости реагирующих веществ и продуктов реакции соответственно;  ,
,  -значения их энтальпий при температуре Т = Т0. Обычно в качестве Т0 берется 298 К, что соответствует t0 = 25 C.
-значения их энтальпий при температуре Т = Т0. Обычно в качестве Т0 берется 298 К, что соответствует t0 = 25 C.  - тепловой эффект реакции при t0 = 250C. В справочниках он приводится для давления 101325 Па (760 мм рт.ст.) Из формул (2.2.11) находим
- тепловой эффект реакции при t0 = 250C. В справочниках он приводится для давления 101325 Па (760 мм рт.ст.) Из формул (2.2.11) находим
 . (2.2.12)
. (2.2.12)
При расчетах по формуле (2.2.12) часто используют приближенные формулы для теплоемкостей
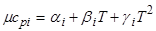 , (2.2.13)
, (2.2.13)
где  ,
, 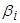 ,
,  - численные коэффициенты. В этом случае продукты
- численные коэффициенты. В этом случае продукты
реакции и реагирующие вещества имеют теплоемкости также представимые в виде (2.2.13), а, следовательно,
 . (2.2.14)
. (2.2.14)
где параметры a,b,g получаются из соответствующих параметров, входящих в формулу (2.2.13), суммированием по индексу i. При этом параметры, относящиеся к продуктам реакции, берутся со знаком "+", а к исходным веществам - со знаком "-".
В случае, когда известны средние теплоемкости, формула (2.2.12) для теплового эффекта представима в виде
 , (2.2.15)
, (2.2.15)
где  - средняя теплоемкость продуктов реакции в интервале
- средняя теплоемкость продуктов реакции в интервале
температур от 0 до t 0С, 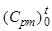 - средняя теплоемкость реагирующих
- средняя теплоемкость реагирующих
веществ в этом же интервале температур.
Аналогичные формулы можно написать, если реакция идет при
постоянном объеме. Соответствующие формулы получаются путем замены индекса р на индекс v. Например,
 . (2.2.16)
. (2.2.16)
Если продифференцировать формулы (2.2.12) и (2.2.16) по температуре, то получим уравнения Кирхгофа:
|
|
|
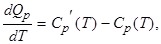
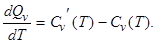
2.2.5. Основы теории горения.
Рассмотрим основы теории горения, когда увеличение температуры рабочего тела происходит в результате химической реакции топлива с воздухом (внутреннее сгорание). Данные процессы протекают в двигателях внутреннего сгорания и в газотурбинных установках, где нагрев газа является единственным средством увеличения его давления или удельного объема. Горячий газ имеет температуру близкую к температуре плавления материалов. В ДВС он быстро охлаждается при расширении, а в газотурбинных установках необходимо ограничить температуру рабочего тела путем использования для горения лишь части (около одной четверти) кислорода, содержащегося в воздухе. Такое ограничение определяет существенное отличие камер сгорания газовых турбин от топочных устройств котельных установок, при конструировании которых стремятся по возможности уменьшить количество избыточного воздуха. Изменение объема рабочего тела при сгорании происходит не только вследствие изменения температуры, но также в результате изменения при реакции числа молекул. При сгорании углеводорода СхНy массы реагентов находятся из уравнения химической реакции
 ,
,
откуда возникает (атомный вес углерода С равен 12, кислорода - 32, водорода -1) соотношение масс
 . (2.2.17)
. (2.2.17)
Следовательно, количество кислорода, необходимое для полного
сгорания 1 г. 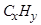 равно
равно
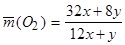 (2.2.18)
(2.2.18)
Из формулы (2.2.18) следует, что для чистого водорода (x = 0, y =1) и чистого углерода (x = 1, y = 0) получается соответственно 8 и 2,67 г. Для углеводородов, входящих в состав обычных топлив, эта величина около 3,48 г.
В качестве окислителя, содержащего кислород, обычно используют воздух, содержащий по весу 0,2319 частей кислорода, 0,7546 - азота и 0,0135 - аргона. В дальнейшем при расчетах будем считать, что воздух состоит из 0,232 частей кислорода и 0,768 частей азота.
Уравнения материального баланса можно использовать для решения следующих двух задач:
|
|
|
1. расчет состава продуктов сгорания, образующихся при сгорании топлива при заданном составе смеси (отношении весовых количеств воздуха и топлива);
2. расчет состава смеси и элементарного состава топлива по известному составу продуктов сгорания.
Считаем, что сгорание происходит до конечных продуктов 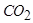 ,
,  и имеется избыточное количество воздуха. Из (2.2.17) следует, что при сгорании 1 кг образуется
и имеется избыточное количество воздуха. Из (2.2.17) следует, что при сгорании 1 кг образуется
 (2.2.19)
(2.2.19)
кг углекислого газа. Обозначим состав смеси через Z (на одну единицу топлива приходится Z частей окислителя). В Z граммах воздуха содержится 0,232 Z кг кислорода и 0,768 Z кг азота. В продуктах сгорания, кроме углекислого газа, содержится несгоревший кислород, масса которого
 (2.2.20)
(2.2.20)
кг и азот с массой
 (2.2.21)
(2.2.21)
кг. Кроме того, в продуктах сгорания присутствует вода с массой
 (2.2.22)
(2.2.22)
кг. Состав смеси, при котором количество кислорода необходимо и достаточно для полного сгорания топлива, называется стехиометрическим.
Чтобы найти стехиометрический состав, нужно содержание кислорода (2.2.20) в продуктах сгорания положить равным нулю. В результате найдем
 (2.2.23)
(2.2.23)
Эта величина приблизительно равна15 для обычных углеводородов. В камерах сгорания газовых турбин величина Z порядка 50, что соответствует концентрации 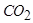 в продуктах сгорания около 4,2%.
в продуктах сгорания около 4,2%.
При сгорании топлива выделяется тепло экзотермической реакции между топливом и кислородом, идущей до образования устойчивых окислов ( ). Эта величина называется теплотворной способностью топлива. Теплотворные способности ряда топлив сведены в таблицу 2.2.2. Когда в продуктах сгорания содержится вода, то она может находиться в жидком и газообразном состоянии. Соответственно различают низшую и высшую теплотворные способности. Разница между ними равна теплоте парообразования воды, которая сравнительно велика.
). Эта величина называется теплотворной способностью топлива. Теплотворные способности ряда топлив сведены в таблицу 2.2.2. Когда в продуктах сгорания содержится вода, то она может находиться в жидком и газообразном состоянии. Соответственно различают низшую и высшую теплотворные способности. Разница между ними равна теплоте парообразования воды, которая сравнительно велика.
Таблица 2.2.2
Теплотворные способности при постоянном давлении и 250С.
| вещество | формула | Состояние | Высшая теплотворная способность, ккал/кг | Низшая теплотворная способность, ккал/кг |
| водород | Н2 | газ | ||
| углерод | С | тверд. | ||
| окись углерода | СО | газ | ||
| метан | СН4 | газ | ||
| этан | С2Н6 | газ | ||
| пропан | С3Н8 | газ | ||
| n - бутан | С4Н10 | газ жидкость | 11837 11749 | 10932 10844 |
| n - октан | С8Н18 | газ жидкость | 11534 11447 | 10705 10618 |
| этилен | С2Н4 | газ | ||
| пропилен | С3Н6 | газ | ||
| ацетилен | С2Н2 | газ |
|
|
|
Теплотворные способности и свойства продуктов сгорания углеводородных топлив, используемых в ГТУ, примерно одинаковы. Это дает
возможность проводить расчеты по средним характеристикам углеводородных топлив. Предложено стандартное топливо, содержащее 86,08% углерода и 13,92 % водорода. При сгорании стандартного топлива продукты сгорания имеют молекулярный вес, близкий к молекулярному весу воздуха 28,97 %. Состав стандартного топлива соответствует формуле (СН1,94)n. Низшая теплотворная способность 10300 ккал/кг при t=15 С.
Химические источники энергии используются для увеличения температуры рабочего тела в результате необратимой реакции горения. Процесс сгорания можно считать адиабатическим, полагая, что тепловые потери через стенки камеры отсутствуют. В этих условиях продукты сгорания приобретают температуру, равную теоретической температуре горения. Теоретическая температура горения рассчитывается следующим образом. Предполагается, что реакция сначала идет изотермически, причем выделяется количество тепла, соответствующее ее тепловому эффекту  . Система переходит из состояния А в состояние В (см. рис.2.2.1). Затем выделенное тепло подводится к продуктам сгорания (см. процесс В-С на рис.23), которые нагреваются до температуры
. Система переходит из состояния А в состояние В (см. рис.2.2.1). Затем выделенное тепло подводится к продуктам сгорания (см. процесс В-С на рис.23), которые нагреваются до температуры  . Следовательно,
. Следовательно,
 , (2.2.24)
, (2.2.24)
где  - средняя теплоемкость продуктов сгорания. Из формулы (2.2.24) следует, что
- средняя теплоемкость продуктов сгорания. Из формулы (2.2.24) следует, что
 . (2.2.25)
. (2.2.25)
Рассмотрим два примера. Возьмем в качестве топлива чистый углерод, а в качестве окислителя воздух. Из формулы (2.2.23) находим  , а из формул (2.2.19), (2.2.21) определяем состав продуктов сгорания при стехиометрическом составе смеси
, а из формул (2.2.19), (2.2.21) определяем состав продуктов сгорания при стехиометрическом составе смеси
 кг,
кг,  кг.
кг.
Следовательно, теплоемкость продуктов сгорания в расчете на 1кг углерода
 ккал/К.
ккал/К.
Здесь 0,23 ккал/(кг К) -удельная теплоемкость углекислого газа, а 0,245 ккал/(кг К)- удельная теплоемкость азота. Теоретическая температура горения, вычисляемая по формуле (2.2.25), равна 2900К.
|
|
|
Проведем теперь аналогичный расчет для метана 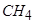 . Теперь в продуктах сгорания присутствуют пары воды, удельную теплоемкость которых при таких температурах примем равной 0,58 ккал/(кг К). Расчеты по формулам (2.2.19) - (2.2.22) дают:
. Теперь в продуктах сгорания присутствуют пары воды, удельную теплоемкость которых при таких температурах примем равной 0,58 ккал/(кг К). Расчеты по формулам (2.2.19) - (2.2.22) дают:
 кг,
кг,  кг,
кг,  ,
,  кг.
кг.
Теплоемкость продуктов сгорания стехиометрической смеси

 ккал/К.
ккал/К.
Теоретическая температура горения
 .
.
Высокие теоретические температуры горения природных топлив приводят к необходимости для обеспечения допустимой температуры перед газовой турбиной в ГТУ осуществлять сгорание при больших избытках воздуха. Это приводит к созданию компрессора с производительностью, превышающей ту, что необходима для сгорания топлива, и соответственно уменьшению коэффициента полезного использования топлива.
|
|
|
|
|
Дата добавления: 2015-06-27; Просмотров: 440; Нарушение авторских прав?; Мы поможем в написании вашей работы!