
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Рассмотрим произвольную химическую реакцию
|
|
|
|
 , (2.2.1)
, (2.2.1)
где 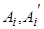 - символы реагирующих веществ и продуктов реакции;
- символы реагирующих веществ и продуктов реакции; 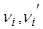 , - стехиометрические коэффициенты, показывающие в каком соотношении реагируют вещества. Например, для реакции окисления водорода
, - стехиометрические коэффициенты, показывающие в каком соотношении реагируют вещества. Например, для реакции окисления водорода
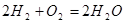 .
.
Здесь 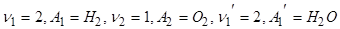 . Два моля водорода, соединившись с одним молем кислорода, дают два моля воды. При этом выделяется тепло Qv или Qp в зависимости от условий протекания реакции (при постоянном объеме или давлении).
. Два моля водорода, соединившись с одним молем кислорода, дают два моля воды. При этом выделяется тепло Qv или Qp в зависимости от условий протекания реакции (при постоянном объеме или давлении).
Давление и температура (или объем и температура), в общем случае, состояние системы не определяют. Необходимо задать еще один параметр, определяющий состояние реакции, т.е. ее состав. Например, число молей кислорода, которое вступило в реакцию. Это определит количество молей других участников реакции. Если в начале был один моль кислорода и 2 моля водорода (стехиометрическая смесь), то по мере протекания реакции, если она идет до конца, эти газы исчезнут, и образуется два моля паров воды. Принимая во внимание огромное число атомов в моле (N = 6,023*10 атомов/ моль), можно считать, что мольный состав системы непрерывно меняется при протекании реакции, и можно применять к ее описанию дифференциальные соотношения.
Рассмотрим сначала изохорно-изотермическую реакцию и предположим, что прореагировала небольшая часть веществ, тогда выделилось количество тепла
 ,
,
т.к. V = const и dV = 0. Складывая теперь выделяющееся тепло по мере протекания реакции, найдем
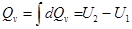 , (2.2.2)
, (2.2.2)
где U2 - внутренняя энергия продуктов реакции, стоящих в ее уравнении (2.2.1) справа, U1 - внутренняя энергия реагирующих веществ, стоящих в уравнении реакции (2.2..1) слева. Подчеркнем, что внутренние энергии берутся для тех количеств веществ, которые определяются стехиометрическими коэффициентами в уравнении реакции (2.2.1). Следовательно, и величина Q вычисляется именно для данной реакции (2.2.1).
Аналогичные рассуждения для изобарно-изотермической реакции дают

откуда
 (2.2.3)
(2.2.3)
Из формул (2.2.2), (2.2.3) следует, что тепловой эффект изохорно-изотермической реакции определяется изменением внутренней энергии системы, а тепловой эффект изобарно-изотермической реакции - изменением энтальпии системы.
Величины Qp и Qv связаны между собой. Эта связь наиболее проста, когда реагирующие вещества и продукты реакции являются идеальными газами, уравнение состояния которых
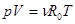 ,
,
где R0 = 8314 Дж/(кмоль К) - универсальная газовая постоянная. В этом случае, входящая в (2.2.3) работа расширения
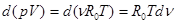 ,
,
где d n - изменение числа молей в результате протекания реакции в части взаимодействующих веществ. Следовательно,
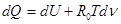 .
.
Складывая выделяющееся тепло по мере протекания реакции, найдем
 , (2.2.4)
, (2.2.4)
где Dn - изменение числа молей в результате протекания реакции. Вспоминая соотношение (2.2.2), из (2.2.4) найдем
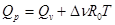 . (2.2.5)
. (2.2.5)
Второе слагаемое справа в формуле (2.2.5) может быть как положительным (Qp >Qv), так и отрицательным (Qp <Qv) или равным нулю(Qp = Qv).
Внутренняя энергия и энтальпия являются функциями состояния, поэтому Qp и Qv определяются только соответствующими начальными и конечными состояниями системы. Это положение составляет основу закона, открытого в 1980 году Г.И.Гессом.
Закон Гесса. Тепловой эффект химической реакции, протекающей через промежуточные стадии, не зависит от этих стадий и порядка их протекания, а определяется только начальным и конечным состоянием системы реагирующих веществ.
Закон Гесса позволяет находить тепловые эффекты химических реакций, непосредственное измерение которых затруднительно. Реакция окисления углерода
C + O2 = CO2, Q1 = -393785 кДж/кмоль (2.2.6)
может протекать через стадию образования СО:
C + 1/2 O2 = CO, Q =?, (2.2.7)
тепловой эффект которой измерить сложно, т.к. эта реакция и реакция
CO + 1/2 O2 = CO, Q2 = -283187 кДж/кмоль (2.2.8)
происходят одновременно с (2.2.6). С другой стороны на основании закона Гесса
Q + Q2 = Q1
или
Q = Q1 - Q2 = -393785 + 283187 = -110598 кДж/кмоль.
При практических расчетах очень удобен алгебраический метод, основанный на законе Гесса. Проиллюстрируем его на примере вычисления теплотворной способности ацетилена Q в реакции
C2H2 + 5/2 O2 = 2 CO2 + H2O (газ) + Q. (2.2.9)
Отметим, что тепловой эффект Q, пока нам неизвестный, включен как равноправный член в уравнение реакции. Тепловые эффекты реакций окисления водорода и углерода, а также тепловой эффект образования ацетилена считаем известными:
1  H2 + 1/2 O2 = H2 O - 57798 ккал,
H2 + 1/2 O2 = H2 O - 57798 ккал,
2 С + O2 = CO2 - 94052 ккал, (2.2.10)
-1 2C + H2 = C2 H2 + 54194 ккал.
Заметим, что если теперь второе уравнение системы (2.2.10) умножить на 2,а последнее на (-1) и почленно сложить с первым, то получим
H2 + 1/2 O2 + 2C + 2O2 - 2C – H2 = H2 O + 2 CO2 - C2H2 -
-(57798 + 2*94052 + 54194)ккал.
Обращаясь теперь с символами веществ как с алгебраическими величинами и перенося C2H2 справа налево, получим
C2H2 + 5/2 O2 = 2 CO2 + H2O - 300096 ккал.
Сравнивая это выражение с (2.2.9), находим
Q = - 300096 кал/моль.
Существует еще один способ определения теплового эффекта химической реакции, основанный на использовании термохимических таблиц. Этот способ описан в следующем параграфе.
|
|
|
|
|
Дата добавления: 2015-06-27; Просмотров: 430; Нарушение авторских прав?; Мы поможем в написании вашей работы!