
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основное уравнение для расчета термомеханической эксергии
|
|
|
|
Изменение термомеханической эксергии в процессе
Вещество (Т, р)® Вещество (Т0, Р0)
происходит в результате теплообмена с ОС и совершения веществом или окружающей средой работы. Обозначим через dQ1 количество тепла, отданное веществом, dQ2 - количество тепла, поступающее в ОС. Тогда совершаемая работа
dА = dQ1 - dQ2.
В силу обратимости всех процессов
dQ2 = Т0dSОС = -Т0dSв-во.
Эксергия окружающей среды Е0С = 0. Поэтому работа по изменению объема окружающей среды при Р0 (работа проталкивания) бесполезна, т.е. не может быть превращена в эксергию.
Для dQ1 можно записать
-dQ1 = dUв-во+ Р0dVв-во.
Тогда
dА = -dUв-во + Р0dVв-во + Т0dSв-во.
Окончательно для термомеханической эксергии запишем
Ет (Т,Р) = -DU + Р0DV + T0DS (4-1)
В случае Р = Р0 уравнение (4-1) примет вид
Е0т(Т) = -DН0 + Т0DS0 (4-2)
где Е0т(Т) - стандартная термомеханическая эксергия при температуре Т.
Уравнение (4-2) можно представить в виде
Е0т (Т) = 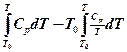 (4-3)
(4-3)
Термомеханическая эксергия идеального газа.
Для расчета термомеханической эксергии в случае идеального газа применим уравнение (4-4)
dАполезн = Ет = dQ1-dQ2 = -dUв-во- p0dVв-во + Т0dSв-во, (4-4)
когда сv = const
ET = cv(T-T0) + T0(cpln 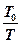 + Rln
+ Rln 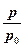 ) - p0(V0-V) =
) - p0(V0-V) =
= cv(T-T0) - T0cpln 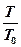 + RT0ln
+ RT0ln 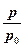 -
- 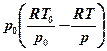 =
=
= cv(T-T0) - T0cpln 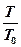 + RT0ln
+ RT0ln 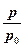 - RT0 + RT
- RT0 + RT 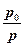 .
.
Добавим и вычтем RT и сгруппируем слагаемые в следующем порядке:
cvT + RT - cvT0 - RT0 +  ¼- RT и учтем, что cp = cv + R
¼- RT и учтем, что cp = cv + R
Eт = cp(T-T0) - cpT0 ln 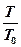 + RT0 ln
+ RT0 ln 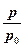 -
- 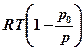
Итого, для идеального газа можно записать:
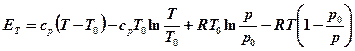 , (4-5)
, (4-5)
или через сv:
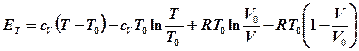 , (4-6)
, (4-6)
Эти выражения для термомеханической составляющей эксергии идеального газа могут быть получены другими независимыми способами.
Расчет концентрационной эксергии.
Концентрационная эксергия обусловлена разностью концентраций веществ отсчета в системе при проведении реакции девальвациии и их концентрациями в модели ОС. В зависимости от агрегатного состояния вещества отсчета выравнивание концентраций будет соответствовать различным процесса, максимальная работа в которых и есть концентрационная эксергия Для газообразных веществ отсчета выравнивание концентраций соответствует расширению (сжатию) газа от давления Р0 до парциального давления Р0i в модели ОС (соответственно от Р0i до Р0) при постоянной температуре. В случае обратимого расширения (сжатия) работа будет максимальна и равна эксергии
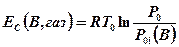 (4-8)
(4-8)
Для растворов и твердых веществ отсчета выравнивание концентраций происходит при Т0, Р0, а максимальная работа при этом равна 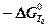
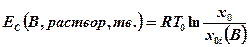 (4-9)
(4-9)
Уравнение (4-9) получено в приближении идеальных растворов. Так как в СТМОС (см. раздел 5) концентрационная эксергия Н2SO4×115Н2О равна нулю, то концентрационная эксергия ЕC (СaН bОcNdSe) равна
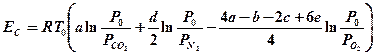 (4-10)
(4-10)
|
|
|
|
|
Дата добавления: 2015-06-27; Просмотров: 1188; Нарушение авторских прав?; Мы поможем в написании вашей работы!