
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лабораторна робота № 15 Потенціометричне титрування хлорид - та йодид - іонів
|
|
|
|
Контрольні питання.
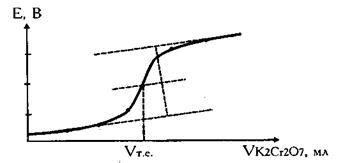
Результати титрування заліза р-ном К2Сr2O7 концентрацією 0,1 M
| Об’єм доданого р-ну К2Сr2O7, мл | ΔV | ЕРС комірки (Е), мВ | ΔЕ | ΔЕ/ΔV |
|
Рис. 3 Крива титрування солі Мора розчином дихромату калію
Розраховують вміст заліза в грамах за формулою:
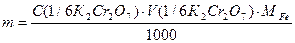
1. Суть потенціометричного метода.
2. Яка залежність виражається рівнянням Нернста? Поясніть суть величин, які входять в це рівняння.
3. В яких випадках використовують пряму потенціометрію, а в яких потенціометричне титрування?
4. В яких координатах будують криві потенціометричного титрування? Чим обумовлений вибір координат?
5. Які функції виконують індикаторні електроди і які – електроди порівняння? Які вимоги до них висуваються?
Мета: Визначити вміст галогенідів у грамах в досліджуваному розчині.
Обладнання та посуд:.
1. Потенціометр рН-метр або іономер.
2. Срібний - індикаторний електрод, хлорсрібний (каломельний) - електрод порівняння;
3. Стаканчик для титрування на 100 мл;
4. Сольовий місток, заповнений насиченим розчином КNO3
5. Мірний циліндр, 25мл;Піпетка на 25 мл;
6. Бюретка на 10 мл,
7.Промивалка
8.Хімічний стакан на 50 мл;
9. 10%-ний розчин Ва(NО3)2;
10. Стандартний розчин АgNO3 0,1 М..
11. Аналізований розчин: суміш розчинів КСl і КІ.
Принцип методу. Визначення галогенід - іонів методом потенціометричного титрування засноване на послідовному осадженні галогенідів срібла, що відрізняються розчинністю:
ДРАgС1=1,78·10-10; ДРАgI=8,3·10-17

Рис. 4 Крива потенціометричного титрування йодид - і хлорид іонів розчином азотнокислого срібла
При титруванні галогенідів азотнокислим сріблом першою випадає менш розчинна сполука - йодид срібла, а другою - хлорид срібла:
Аg++I-  АgI
АgI
Аg++Cl-  АgCl
АgCl
Концентрація Аg+, необхідна для утворення АgI, дорівнює ДРАgI/[І-]. При зменшенні концентрації йодид-іонів, концентрація іонів [Аg+], необхідна для осадження йодиду, збільшується. Утворення хлориду срібла почнеться в момент, коли концентрація іонів срібла буде дорівнювати: [Аg+]=ДРAgCl/[Cl-].
Потенціометричне титрування нітратом срібла здійснюють зі срібним індикаторним електродом на фоні електроліту Ва(NО3)2, який додають для коагуляції осадів і підтримки постійної іонної сили розчину. Електрод порівняння- каломельний або хлорсрібний. їх занурюють у додатковий стаканчик і з’єднують з аналізованим розчином за допомогою електролітичного ключа, заповненого агар-агаром та КNО3.
На потенціометричній кривій (рис. 3) одержують два характерних стрибки, відповідних точці еквівалентності йодид-іонів (І стрибок) і точці еквівалентності хлорид-іонів (II стрибок).
Хід аналізу. У стаканчик для титрування поміщають розчин аналізованої суміші, додають 25 см3 10% Ва(NО3)2, опускають індикаторний срібний електрод. Комірку з’єднують електролітичним ключем (сольовим містком) із хлорсрібним електродом порівняння, що знаходиться в насиченому розчині КСl (або з каломельним електродом порівняння). Вимірюють потенціал срібного електрода і приступають до титрування розчином додаючи титрант спочатку по 0,5 см3, а поблизу точок еквівалентності - по 0,1 см3. Записують показання приладу. Після першого різкого стрибка потенціалу продовжують титрування хлорид-іонів.
На підставі отриманих даних будують криві титрування Е (мВ) — V (мл) (рис. 3) і ΔЕ/ΔV—V, з яких визначають дві точки еквівалентності. Розраховують вміст галогенідів у грамах за формулами:
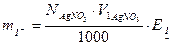

де V1, V2 — об’єми стандартного розчину АgNО3, витраченого на титрування відповідно до першої і другої точок еквівалентності. Знаходять середнє значення з трьох результатів. Виконують статистичну обробку результатів.
|
|
|
|
|
Дата добавления: 2015-06-28; Просмотров: 1466; Нарушение авторских прав?; Мы поможем в написании вашей работы!