
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обогощение твердого сырья 1 страница
|
|
|
|
По отнош к нагреванию:Термопластичные-не меняют св-во и стр-ние после нагрев и охлажд.При нагрев размягчаются,при охлажд отвердевают.Мол им линейное или разветв стр-е.Термореактивные-при нагрев теряют спос-сть плавится,растворятся.Процесс превращ линейной стр-ры в сетчатую-отверждением или сшивкой.Полиэлектролиты. Полиэлектролитами-ВМС, им ионогенные гр.значение-важнейшие прир соед – белки и НК. Полиамфолиты – ВМС,сод и кисл,и основн гр(белки с гр и – NH3+).Микроструктура. АК образ полипеп цепь.Чередов АК в цепи-важней фактор,опред биол ф-цию белка и его специфичность.
Полипепт цепь – это перв стр-ра белк мол с опред послед-ю располож АК. В рез-те спирализ. Или образ изгибов цепочки приобретают трёхмерность, образ вторичную стр-ру белка.Цепи связыв водород и дисульф св.в нек белках неск спиралей соед, образ более толстый пучок полипеп цепей.Нек кол-во таких пучков может образ ещё более объём пучок цепочек,нап многожильный кабель или сворачиваться в сл клубок– третичная стр-ра. Макростр-ра. В рез-те объед микроструктур образ четвертичная стр-ра. Конд субъед”конец в конец”приводит к возникнов длин фибрил макростр-р белка– миофибр, эласт и коллаг волокон.Соед субъед”бок о бок”приводит к образ глобул макростр-р–гемоглобин,миоглобин. ИЭТбелков заряд белк мол в нейтр среде опред соотн кол-ва своб гр– 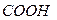 и–
и–  и ст их диссоц.Чем больше СООН, тем выше отриц заряд,белок-проявл св-ва сл к-ты.Белки отн-ся к полиамфолитам. Состояние,при кот сум заряд полиамфолита=0-изоэлектр.pH р-ра,соотв изоэлектр сост-ИЭТ(pi).Возникновение электрического заряда в состоянии, отличающемся от изоэлектрического, обусловливает электрофоретическую подвижность белков.В изоэлектр сост св-ва р-ров белков резко меняются.При рН,близком к ИЭТ, разноим заряж гр–NH3+ и –СОО- притяг-ся друг к другу и спир-ся.При смещ рН от ИЭТ одноим заряже гр отталкив и цепь выпрямляется. Методы определения ИЭТ:1 По электрофоретической подвижности. белок подвергают электрофорезу в буф р-рах с разным рН.2 По ст коагуляции. наливают буф р-ры с разл рН,вносят разн кол-ва исслед белка и доб спирт.2 По скорости желатинирования. 4 По величине набухания. Высаливание −выдел в осадок раств-го в-ва,вызыв добавкой к р-ру больших кол-в нейтр солей.Для высаливания треб-ся большие кол-ва солей.Высалив.наступ из-за наруш сольватной связи между макромол ВМС и р-лем,(десольватации частиц.)Коацервация- раздел с-мы на две фазы,1 р-р ВМС в р-ле,2– р-р р-ля в ВМС,при изм тем-ры,рН или при введ низкомол в-в.От высаливания отлич тем,что ВМС не выд сразу. Денатурация -это любая модифик вторичной,третичной или четвертичной стр-ры белк мол,за исключ разрыва ков св.Денатурир агенты: к-ты и щёлочи,(3>pH>10);легко гидратирующ соли;орг раств-ли (ацетон,СН3ОН и С2Н5ОН),сним водную оболочку у белков; ок-ли, производ разрыв дисульф мостиков. физ факторы:Т выше 50-600С; черед оттаивания и заморажив;ультразвук денатур При денатур: наруш форма и р-ры мол;измен уд оптич акт-сть;увелич вязкость;уменьша раств-сть белков и ст набухания;происх снятие с колл ч-ц электр заряда. специфич биолог св-ва: уменьш или потерю ферментативной и иммунологич акт-ти;субстраты белк природы более легко подверг гидролитич
и ст их диссоц.Чем больше СООН, тем выше отриц заряд,белок-проявл св-ва сл к-ты.Белки отн-ся к полиамфолитам. Состояние,при кот сум заряд полиамфолита=0-изоэлектр.pH р-ра,соотв изоэлектр сост-ИЭТ(pi).Возникновение электрического заряда в состоянии, отличающемся от изоэлектрического, обусловливает электрофоретическую подвижность белков.В изоэлектр сост св-ва р-ров белков резко меняются.При рН,близком к ИЭТ, разноим заряж гр–NH3+ и –СОО- притяг-ся друг к другу и спир-ся.При смещ рН от ИЭТ одноим заряже гр отталкив и цепь выпрямляется. Методы определения ИЭТ:1 По электрофоретической подвижности. белок подвергают электрофорезу в буф р-рах с разным рН.2 По ст коагуляции. наливают буф р-ры с разл рН,вносят разн кол-ва исслед белка и доб спирт.2 По скорости желатинирования. 4 По величине набухания. Высаливание −выдел в осадок раств-го в-ва,вызыв добавкой к р-ру больших кол-в нейтр солей.Для высаливания треб-ся большие кол-ва солей.Высалив.наступ из-за наруш сольватной связи между макромол ВМС и р-лем,(десольватации частиц.)Коацервация- раздел с-мы на две фазы,1 р-р ВМС в р-ле,2– р-р р-ля в ВМС,при изм тем-ры,рН или при введ низкомол в-в.От высаливания отлич тем,что ВМС не выд сразу. Денатурация -это любая модифик вторичной,третичной или четвертичной стр-ры белк мол,за исключ разрыва ков св.Денатурир агенты: к-ты и щёлочи,(3>pH>10);легко гидратирующ соли;орг раств-ли (ацетон,СН3ОН и С2Н5ОН),сним водную оболочку у белков; ок-ли, производ разрыв дисульф мостиков. физ факторы:Т выше 50-600С; черед оттаивания и заморажив;ультразвук денатур При денатур: наруш форма и р-ры мол;измен уд оптич акт-сть;увелич вязкость;уменьша раств-сть белков и ст набухания;происх снятие с колл ч-ц электр заряда. специфич биолог св-ва: уменьш или потерю ферментативной и иммунологич акт-ти;субстраты белк природы более легко подверг гидролитич
расщеплению.Денатур белки быстрее перевар-ся ферментами ЖКТпо ср-ю с нативными. Коллоидная защита. р-ры ВМС,значит повыш агрегат устойчивость.Защищенный золь может сущ-ть в р-ре в больших конц, чем незащищ.В нек случаях защищ золи стан-ся обратимыми.После удал раств-ля он прев-ся в сухой колл порошок,раств-мый затем в любых количествах воды.
Защитное действие растворов ВМС зависит от природы вещества и природы защищаемого им золя. Количественно оно характеризуется так называемым золотым числом, которое выражается минимальным числом миллиграммов сухого ВМС, которое предохраняет 10см3 красного гидрозоля золота от перемены окраски при добавлении к нему 1 см3 10%-ного раствора хлорида натрия. Защитное действие различных ВМС весьма различно. Особенно высоким защитным действием обладают белки. Явление защиты играет важную роль в ряде физиологических процессов. Так, например, защитные вещества белкового характера удерживают в дисперсном состоянии находящиеся в крови трудно растворимые фосфат и карбонат кальция. При некоторых заболеваниях содержание защитных веществ в крови понижается, что приводит к выпадению указанных солей в осадок (образование камней в почках, печени, отложение солей на суставах). Многие лекарственные вещества являются защищенными золями (колларгол, протаргол и др.).
Биологическое значение коллоидной защиты. Явление коллоидной защиты имеет большое физиологическое значение: многие гидрофобные коллоиды и частички в крови и биологических жидкостях защищены белками от коагуляции. Так, белки крови защищают капельки жира, холестерин и ряд других гидрофобных веществ. Снижение степени этой защиты приводит к отложению, например, холестерина и кальция на стенках сосудов (атеросклероз и кальциноз).
50. Студни - структурированные гомог с-мы,зап жидкостью,каркас образ мол ВМС. Студни –гомогенные аморфные эластичные структурированные системы, состоящие из полимера и низкомолекулярной жидкости. Характеризуются отсутствием текучести, способностью сохранять форму, прочностью и упругостью. Эти свойства обусловлены наличием пронизывающей весь объём студня пространственной сетки макромолекул. Пространственная сетка студней имеет молекулярные размеры и образована химическими или водородными связями. Повторное разрушение студня – тиксотропия.К студням первого типа относят набухшие в растворителях сетчатые полимеры. напр. полистирол с поперечными дивинилбензольными "мостиками". Студни второго типа отличаются от студней первого типа отчетливо выраженным двухфазным состоянием В зависимости от природы веществ, образующих структурированные системы (гели), различают хрупкие гели и эластичные гели (студни). Хрупкие гели построены из жестких частиц. Застудневание. При этом осадка не образуется, а вся система, утрачивая текучесть, переходит в особое состояние, называемое студнем. Застудневание – процесс, при котором макромолекулы, связываясь между собой на отдельных участках, образуют рыхлую пространственную структуру или «каркас», в ячейках которого прочно удерживается весь объём растворителя.Застудневание происходит: 1) в результате межмолекулярного притяжения между макромолекулами ВМС; 2) за счет возникновения между молекулами ВМС водородных связей; 3) при введении добавок посторонних веществ, способствующих образованию дополнительных химических связей ("сшивающих мостиков") между макромолекулами ВМС. На процесс застудневания влияют: 1) концентрация ВМС в растворе; 2) температура; 3) примеси других веществ, особенно электролитов. С повышением концентрации ВМС уменьшаются расстояния между частицами и скорость застудневания увеличивается. Для каждой системы при данной температуре существует некоторая концентрация, ниже которой она не застудневает. С понижением температуры уменьшается скорость движения макромолекул, вследствие чего облегчается процесс их сцепления, приводящий к застудневанию. Эти факторы используют на практике при изготовлении пищевых студней, желе и других изделий. Условия образования студней. Необходимое условие гелеобразования – частичное понижение растворимости полимера в растворителе. Оно достигается изменением температуры, природы растворителя либо введением осадителя. Образование студней может происходить различными путями: 1) при самопроизвольном набухании пространственно-сшитых полимеров; 2) при трёхмерной полимеризации или поликонденсации в растворе или в процессе химических реакций сшивания в присутствии растворителей; 3) при охлаждении концентрированного раствора полимера, способного образовывать пространственную сетку за счёт межмолекулярных связей. Для образования студня третьего типа необходимы такие условия, чтобы; а) набухание полимера происходило в плохом растворителе; б) раствор, из которого образуется студень, был вынужденно образованным, т.е. чтобы растворение полимера происходило только при нагревании; в) концентрация раствора была достаточной для образования в системе сплошной пространственной сетки. Процесс отделения растворителя от студня называется синерезисом. При этом пространственная сетка становится более хрупкой. Этот процесс идёт до тех пор, пока концентрация студня не станет равновесной, т.е. количество растворителя, поглощённого полимером при образовании студня,не станет отвечать равновесному при данной температуре. Периодические реакции в гелях и студнях. В гелях и студнях реагирующие вещества соприкасаются только в результате медленно протекающего процесса диффузии, поэтому химические реакции в студнях идут с небольшой скоростью, причем в соседних участках студня могут возникнуть независимо одна от другой различные реакции.Характер реакции в гелях и студнях во многом зависит от растворимости вновь получаемого вещества. Если продукт реакции растворим, то диффузия идет в обоих направлениях.Если в результате реакции получается нерастворимое вещество, то образование осадка возможно в растворе, на поверхности или внутри геля.Периодическими реакциями объясняют возникновение слоистой узорчатости многих минералов, полосатость различных органов растений и животных, слоистость в строении «камней» в почках и печени. Значение и практическое применение студней. Студнеобразование и студни находят широкое применение в производстве вискозного, ацетатного и медноаммиачного шелка, различных типов искусственной кожи, резиновых изделий из синтетических латексов и растворов каучука, плащевых материалов (поливинилхлорида, поливинилацетата и др.), в изготовлении и применении растительных и животных клеев, в отделке кожи, ткане.Не менее важны студни в производстве продовольственных товаров. Хлеб, мясо, различные сорта сыра, творог, простокваша, мармелад, джем, желе, студень, кисель – типичные студни.В хлебопечении, сыроварении, кондитерском производстве, консервировании плодов и ягод, изготовлении многих пищевых блюд студнеобразование – одна из стадий технологического процесса. Набухание – это самопроизвольный процесс поглощения низкомолекулярного растворителя высокомолекулярным веществом, сопровождающийся увеличением массы и объема полимера. Набухание – процесс одностороннего смешивания, при котором молекулы низкомолекулярного вещества, благодаря большой подвижности, проникают в пространство между молекулами высокомолекулярного вещества. При огранич набухании объем и масса полимера достиг опред значений и дальнейший контакт полимера с р-лем не приводит к каким-либо изменениям.В рез-те огранич набухания полимер превраща в студень. При неогран- отсутст предел набухания, со врем полимер поглощ все больш кол-во жидкости и набухание перех в раств-е.(набухание резины в бензине;каучука в этом же раств-ле неогран).На хар-р влияет тем-ра.Причина:диффузия низкомол р-ля в ВМС.
51. Эмульсии-дисперсные системы,состоящие из двух взаимно нерастворимых жидкостей, одна из которых, распределяется в другой в виде мельчайших капелек. Если одна фаза образована полярной жидкостью, то другая - неполярная жидкость. Различают два основных типа эмульсий - дисперсии масла в воде (м/в) и дисперсии воды в масле (б/м). Первые относятся к эмульсиям прямого типа или первого рода, вторые — к эмульсиям обратного типа или второго рода. В зависимости от условий получения может образоваться прямая или обратная эмульсия. При изменений условий один тип эмульсии может превратиться в другой: в/м ↔ м/в. Это явление косит название обращения фаз эмульсий. В зависимости от содержания дисперсной фазы эмульсии классифицируют на разбавленные (содержание дисперсной фазы менее 1% по объему), концентрированные (до 74% объема) и высококонцентрированные (свыше 74 % объема).
Эмульсии можно получить методами конденсации или диспергирования. Пределом эмульгирования считается момент, когда добавленная очередная порция жидкости не диспергируется, а образует крупные капли и прожилки в объеме эмульсии.Устойчивость эмульсии повышают введением в систему стабилизатора (эмульгатора), в качестве которого можно использовать электролиты, ПАВ и высокомолекулярные соединения. Агрегагивная устойчивость эмульсий определяется теми же факторами, которые обуславливают устойчивость к коагуляции других лиофобных дисперсных систем. Разбавленные эмульсии могут быть достаточно устойчивы в присутствии таких слабых эмульгаторов, как электролиты. Устойчивость этих эмульсий связана в основном с наличием двойного электрического сдоя на частицах дисперсной фазы. Устойчивость концентрированных и высококонцентрированных эмульсий в большинстве случаев определяется действием структурно-механического барьера при образовании адсорбционных слоев эмульгатора. Образующиеся межфазные адсорбционные слои обуславливают плавное изменение свойств переходной зоны на границе раздела двух жидких фаз, увеличивая лиофильность частиц дисперсной фазы. Наиболее сильное стабилизирующее действие оказывают ВМС и коллоидные ПАВ (мыла, неионогенные ПАВ), адсорбционные слои которых имеют гелеобразную структуру и сильно гидратированны. Инверсия (обращение фаз) - это превращение эмульсии одного типа в другой путем добавления к ней большого количества эмульгатора другого рода при энергичном перемешивании. При этом дисперсная фаза становиться дисперсионной средой, а дисперсионная среда - дисперсной фазой. Классификация эмульгаторов. Поверхностно-активные вещества-эмульгаторы разделяют по: 1) структуре и свойствам молекул; 2) типу образуемых эмульсий; 3) механизму действия; 4) медицинскому назначению.1. В соответствии с особенностями строения молекул эмульгаторы делятся на анионактивные (гидрофильная часть молекулы в растворе несет отрицательный заряд), катионактивные (гидрофильная часть несет положительный заряд), амфотерные (заряд изменяется с изменением рН раствора) и неионогенные (вообще не ионизируют в растворах). К числу анионактивных эмульгаторов относятся мыла, алкилсульфаты. К катионактивным – инвертные мыла. 2. По типу образуемых эмульсий эмульгаторы делятся на гидрофильные, образующие эмульсии типа м/в, и олеофильные. образующие эмульсии типа м/в. К числу гидрофильных, эмульгаторов относятся белки, слизи, крахмал, декстрин, агар-агар, многие растительные экстракты, соли желчных кислот, щелочные мыла. К группе олеофильных эмульгаторов принадлежат мыла двух- и трехвалентных металлов, стерины, смоляные мыла, амиды жирных кислот, высокомолекулярные одноатомные спирты и т. д.3. По механизму действия эмульгаторы можно подразделить на: 1) собственно поверхностно-активные вещества, стабилизирующие эмульсии за счет резкого уменьшения поверхностного натяжения на межфазной границе; 2) гелеобразователи, стабилизирующие эмульсии путем образования прочных адсорбционных пленок на границе раздела фаз; 3) эмульгаторы смешанного действия. Большинство эмульгаторов, применяемых в фармацевтической практике, относятся к последнему типу.4. По медицинскому назначению эмульгаторы делятся на используемые в эмульсиях для наружного и внутреннего применения. Первой стадией механического диспергирования является растягивание больших капель диспергируемой жидкости, причем они принимают близкую к цилиндру нити форму. Вторая стадия состоит в том, что жидкий цилиндр при известных размерах оказывается неустойчивым и самопроизвольно распадается на капельки неравных размеров (меньшую и большую). Деформации капель способствует происходящее также при диспергировании и сжатие капель. В 3 стадии часть капель коалесцирует при продолж процессе диспергиров в рез-те растягивания более крупных капель в неустойчивые цилиндры критической длины и их самопроизвольного деления.При этом часть мелких капелек стабилизируется присутствующим в системе эмульгатором
52.Анализ –это совокупность действий, целью которых является получение информации о химическом составе объекта. Принцип анализа – явление, которое используется для получения аналит-ой информации. Метод анализа – краткое изложение принципов, положенных в основу анализа в-ва. Методика анализа – подробное описание выполнения анализа данного объекта с использованием выбранного метода анализа, обеспечивает правильность и воспроизводимость. Проба (образец) – это предмет исследования, объект, взятый для анализа. Пробы бывает разовая, мгновенная, суточная, исходная, контрольная.В ходе почти любого анализа можно выделить следующие основные этапы: 1-отбор пробы; 2-подготовка пробы; 3-получение аналит-го сигнала; 4-обработка пробы; 5-интерпретация результатов. Выделяют: макроанализ — используют навески массой 10 — 100 г; • полумикроанализ — навески массой от 0,1 до 1 г;•микроанализ — навески массой 0,001 г и менее, объемы растворов порядка 0,001 мл; результаты реакций наблюдают под микроскопом.
Методы количественного анализа можно разделить на три большие группы:химические, физические, физико-химические. Химические методы
: Гравиметрические методы: заключается в выделении вещества в чистом виде и его взвешивании. Недостатком гравиметрический методов является длительность определения, особенно при серийных анализах большого числа проб, а так же неселективность – реагенты-осадители за небольшим исключением редко бывают специфичны. Титриметрические методы: основанные на измерении количества реагента В, затраченного на реакцию с определяемым компонентом А. В титриметрии используют три способа титрования: прямое, обратное и титрование заместителя. Аналитический сигнал — среднее значение результатов измерения физической величины в заключительной стадии анализа, функционально связанное с содержанием (концентрацией) определяемого компонента. Примеры аналитического сигнала: масса гравиметрической формы (гравиметрия), объем раствора титранта (титриметрия), оптическая плотность раствора электрода (фотометрия), потенциал (потенциометрия). Аналитический сигнал складывается, как правило, из полезного аналитического сигнала, являющегося функцией концентрации определяемого компонента, и аналитического сигнала фона, обусловленного наличием побочных компонентов, входящих в состав исследуемого объекта, или примесей в реактивах, а также «шумами», возникающими при работе аналитических приборов. Важнейшие характеристики аналитической методики. Предел обнаружения (сminP) – наименьшее содержание при котором по данной методике можно обнаружить присутствие определяемого компонента с заданной доверительной вероятностью(Р)-доля случаев,в которых ср. арифметич. Предел определения – наименьшее содержание аналита, которое может быть количественно определено с помощью данной методики анализа вещества или материала с установленными значениями характеристик погрешности или неопределенности. Интервал определяемых содержаний – область, в кот. находятся значения, определяемых количеств компонентов. Нижняя граница (Сn) – наименьшее значение опред-го содержания, огранчив. интервал опред-х содержаний. Правильность (точность) – близость полученных результатов к истинному значению опред-мой величины. Воспроизводимость – определяется разбросом повторных результатов анализа и обуславливается наличием случайных погрешностей. Чувствительность – наименьшее количество вещества, которое можно обнаружить данной реакцией или количественно определить данным методом анализа. Химический анализ – комплекс последовательных операций, направленных на получение достоверной информации о качественном и количественном составе анализируемого объекта. К основным стадиям анализа относят: 1) определение цели анализа; 2) отбор представительной пробы анализируемого материала; 3) оценку качественного состава пробы; 4) выбор метода анализа; 5) обработку пробы с целью ее перевода в удобную для определения форму; 6) измерение аналитического сигнала, связанного с концентрацией определяемого компонента; 7) вычисление и обработку результатов определения. ПОДГОТОВКА ПРОБЫ. Определению предшествуют перевод пробы в удобную для анализа форму (агрегатное состояние), ряд предварительных химических операций (например, маскирование), выделение и концентрирование определяемых; компонентов, их превращение в определяемую форму с более выраженными аналитическими свойствами, создание благоприятных условий для измерения аналитического свойства Метод градуировочного графика: готовится серия стандартных р-ров с разными концентрациями в-ва, для каждого р-ра – величина аналит. Сигнала (оптическая плотность). В качестве аналит. сигнала в случае внутреннего стандарта исп-ся отношение сигналов определяемого в-ва к внутреннему стандарту (I/Iвс). Обычно зависимость линейная.(величина сигнала от конц.): y=a+bx, и y=bx (если прямая не проходит через начало координат), где в-угловой коэффициент либо коэф-т чувствительности. Угол наклона графика. А-величина сигнала контрольного опыта. Качество получ. графика определяет коэф-т корреляции (R). Для практич. целей используются графики, где R>0,99. град. график в таком интервале, чтобы неизвестная конц-ия попадала на середину. Метод стандартов: одного стандарта измеряют величину сигнала стандарта (уст) для р-ра с заданной концентрацией (Сст). Измеряют аналит. сигнал(ух) для р-ра с неизв. конц-ей (Сх): Сх=См*ух / Уст. Такой способ исп-ся если зависимость описывается ур-ем у=вх, необходимо знать величину сигнала. Метод добавок используется при анализе сложных матриц, когда матричные компоненты оказывают влияние на величину аналит. сигнала. расчетный метод или град. графика. при расчетном – измеряют величину аналит. сигнала для пробы с неизв. конц-ей (Ух),затем к пробе добавляют точное кол-во определяемого в-ва(стандарта) и измеряют величину аналит. сигнала(У доб) и концентрацию: Сх=Сдоб*Ух/(Удоб-Ух
53. Гравиметрическим анализом называют метод количественного химического анализа, основанный на точном измерении массы определяемого вещества или его составных частей, выделяемых в виде соединений точно известного постоянного состава. Гравиметрические определения можно разделить на три группы: методы осаждения, отгонки и выделения. Гравиметрический метод основан на точном измерении массы вещества известного состава, химически связанного с определяемым компонентом и выделенного в виде соединения или в виде простого вещества.Классическое название метода-весовой анализ. Гравиметрический анализ основан на законе сохранения массы вещества при химических превращениях и является наиболее точным из химических методов анализа: предел обнаружения составляет 0,10 %; правильность ±0,2 В гравиметрическом анализе используют методы осаждения, отгонки, выделения, термогравиметрию, электрогравиметрию. Методы осаждения основаны на осаждении определяемого компонента в виде малорастворимого химического соединения, фильтровании, прокаливании до постоянной массы и последующем определении массы полученного вещества.. Методы отгонки основаны на отгонке определяемого компонента в виде летучего соединения с последующим определением массы отогнанного вещества (прямое определение) или массы остатка (косвенное определение). Методы выделения основаны на количественном выделении определяемого компонента из анализируемого раствора путем химической реакции с последующим определением массы выделенного вещества В методе осаждения определяемый компонент вступает в химическую реакцию с реагентом, образуя малорастворимое соединение. После проведения ряда аналитических операций твердый осадок известного состава взвешивают и проводят необходимые вычисления1.Расчет массы навески анализируемого вещества и ее взвешивание.2.Растворение навески. 3.Создание условий осаждения4. Осаждение5.Отделение осадка фильтрованием 6.Промывание осадка 7.Получение гравиметрической формы 8.Взвешивание гравиметрической формы 9. Расчет результатов анализа. Механизм реакции осаждения. В процессе образования осадка различают три основных параллельно протекающих процесса: 1) образование зародышей кристаллов; 2) рост кристаллов; 3) объединение хаотично ориентированных мелких кристаллов.В начальный момент смешивания реагирующих компонентов раствор, содержащий эти компоненты, пересыщается и образуются мельчайшие частицы осадка - зародыши. Зародыш кристалла - наименьший агрегат атомов, молекул или ионов, который образуется в виде твердой фазы при осаждении и способен к самопроизвольному росту.Рост кристаллов происходит за счет диффузии ионов к поверхности растущего кристалла и осаждения этих ионов на его поверхности и определяется не только диффузионными процессами, но и структурой растущих кристаллов, дефектами кристаллической решетки, внедрением в нее различных ионов.Число и размер частиц осадка зависят от соотношения скорости образования зародышей кристаллов и скорости роста кристаллов. Если скорость образования зародышей кристаллов мала по сравнению со скоростью роста кристаллов, образуется небольшое число крупных частиц - осадок крупнокристаллический, при обратном соотношении скоростей получается мелкодисперсный осадок, состоящий из большого числа мелких частиц. Скорости обоих процессов зависят от относительного пересыщения раствора, которое определяется выражением: Относительное пересыщение=(C-S)/S, Требования к осадителям: 1.Осадитель должен образовывать с исследуемым компонентом осадок, обладающий наименьшей растворимостью.2.Осадитель должен быть летуч, чтобы примеси его можно было удалить при прокаливании.3.Осадитель должен быть специфичным, т. е. осаждать избирательно.Два вида соосаждения в кристаллических осадках: инклюзия - примеси в виде индивидуальных ионов или молекул гомогенно распределены по всем кристаллу; окклюзия - неравномерное распределение многочисленных ионов или молекул примеси, попавших в кристалл из-за несовершенства кристаллической решетки.Методы осаждения часто применяют как методы разделения. Гравиметрический анализ по методу осаждения применяют при анализе эталонов для калибровки и контроля физико-химических методов анализа, при определении состава синтезированных соединений Аналитические весы -это точный физический прибор, пользование которым допускается при строгом соблюдении правил, обеспечивающих необходимую воспроизводимость и точность взвешивания. Правила обращения с аналитическими весами включают следующие основные требования: 1. Весы должны быть установлены на жестко закрепленной поверхности, защищающей их от различных потрясений, и в специально оборудованном помещении-весовой комнате.2.Недопустимы резкие колебаниятемпературы, действие прямых солнечных лучей, а также воздействие на аналитические весы химических веществ.3.Предельно допустимая нагрузка аналитических весов должна быть не более 200 г 4. При взвешивании предметов на аналитических весах необходимо, чтобы они имели температуру весовой комнаты. 5. Взвешиваемое вещество помещают на левую чашку весов в специальной таре (бюксы, тигли, часовое стекло). Гири аналитического разновеса помещают на правую чашку весов. 6. Взвешиваемые предметы и гири вносят через боковые дверцы весов.Взвешив произв при закрытых дверцах весов.7. Гири аналит разновеса берут только специ предназн пинцетом.Все операции со сменой разновеса производят при полном арретировании весов.8.До и после взвешив необх проверять нулевую точку9.гири и взвешиваемые предметы помещают в центр чашек.10.Запись рез-ов взвешив проводят по пустым гнездам аналити разновеса и по данным барабанов с десятыми и сотыми долями грамма. Третий и четвертый знаки после запятой снимают со светящегося табло. 11. По окончании взвешивания необходимо убедиться, что весы арретированы, полностью разгружены и дверцы футляра плотно закрыты.
54. В основе всех химических методов количественного анализа лежат два химических закона: 1. закон постоянства состава - каждое химическое вещество имеет определенный химический состав: 2. закон эквивалентов - все химические элементы ими их соединения вступают в химические реакции в строго определенных количествах, пропорциональных их химическим эквивалентам.
Титриметрический анализ основан на точном измерении количества реактива (В), израсходованного на реакцию с определяемым веществом (А). Процесс определения содержания вещества или точной концентрации раствора аналитическим путем называется титрованием. Эта важнейшая операция титриметрического анализа заключается в том, что к исследуемому раствору, приливают другой раствор точно известной концентрации до окончания реакции. Следовательно, такое определение возможно только в том случае, если количество прибавляемого реактива эквивалентно количеству определяемого вещества. Для того чтобы определить концентрацию одного из растворов, надо знать точно объемы реагирующих растворов, точную концентрацию другого раствора и момент, когда титруемое вещество прореагирует полностью. Важнейшими моментами титриметричеекях определений являются: 1. точное измерение объемов реагирующих веществ; 2. приготовление растворов точно известной концентрации (рабочие растворы или титранты); 3. определение конца реакции (точки эквивалентности).
|
|
|
|
|
Дата добавления: 2015-06-28; Просмотров: 438; Нарушение авторских прав?; Мы поможем в написании вашей работы!