
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
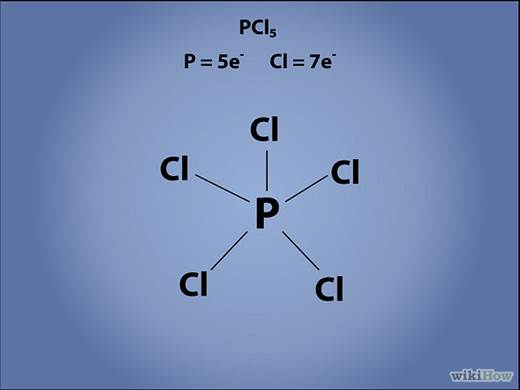
На конце каждой черточки запишите химический символ связанного атома
|
|
|
|
Запишите химический символ центрального атома.
4. 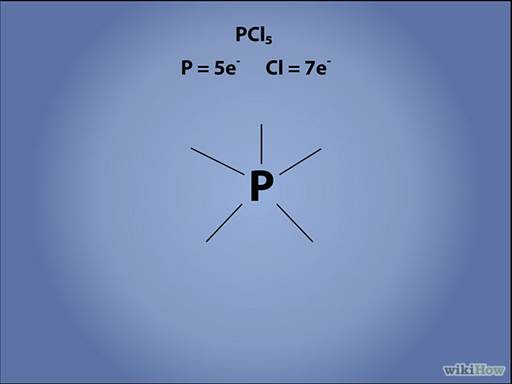
Укажите геометрию электронов вокруг центрального атома. Каждую неподеленную электронную пару обозначайте двумя маленькими точками, расположенными рядом. Каждую одинарную связь изображайте в виде черточки, отходящей от атома. В случае двойных и тройных связей рисуйте, соответственно, две или три черточки.
5. 
6. 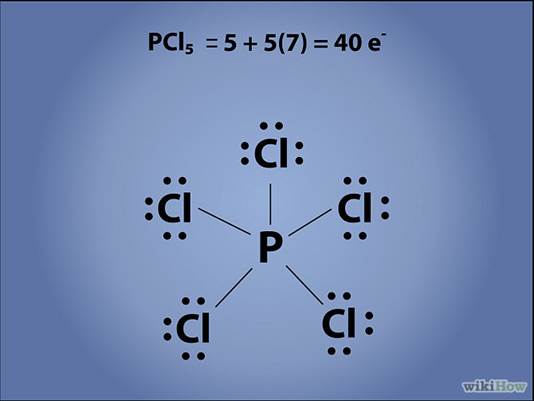
А теперь нарисуйте остальные электроны вокруг остальных атомов.Рассматривая каждую связь как 2 электрона (двойные и тройные связи – как 4 и 6 электронов соответственно), сложите все электронные пары: число валентных электронов вокруг каждого атома должно быть равно 8.
· Безусловно, к исключениям относятся атомы, которые не подчиняются правилу октета, и водород, у которого во всех случаях могут быть или 0, или 2 валентных электрона. Когда атом водорода связан ковалентно с другим атомом, у него нет неподеленных электронов.
Метод 3 из 3: Ионы
1. 
Чтобы изобразить точечную структуру Льюиса одноатомного иона (всего один атом), запишите сначала его химический символ. Затем нарисуйте столько электронов вокруг него, сколько валентных электронов у него есть изначально плюс или минус число электронов, которые он приобрел или потерял в результате ионизации.
· Например литий при ионизации теряет один и единственный валентный электрон. Поэтому его льюисовская структура будет иметь вид Li, без точек вокруг символа.
· Хлор при ионизации приобретает один электрон, что обеспечивает ему заполненную оболочку из 8-ми электронов. Поэтому, его льюисовская структура будет выглядеть как Cl с 4-мя парами точек вокруг него.
2. 
|
|
|
|
|
Дата добавления: 2015-06-28; Просмотров: 323; Нарушение авторских прав?; Мы поможем в написании вашей работы!