
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кинетика каталитической реакции окисления паров ацетона
|
|
|
|
Реальные процессы протекают в условиях, далеких от равновесия с определенной конечной скоростью и при повышенных температурах.
Скорость протекания реакции можно выразить с помощью кинетического уравнения:
ω = k1 · Cn1ац Сn2О2
где k1 –константа скорости, которая не зависит от концентрации реагентов и растет с увеличением температуры; n1 и n2 –частные порядки реакции по ацетону и кислороду.
В данном случае реакция протекает при большом избытке кислорода, поэтому можно принять СО2 = const, тогда
ω = k1 · Cn1ац = k1 · Сn2О2
где k = k1 · Сn2О2 ; С – концентрация ацетона; n –порядок реакции.
Окисление ацетона ведем на твердом катализаторе. Процесс- гетерогенный и может проходить в кинетической и диффузионной области. Для определения порядка реакции и константы скорости такого сложного процесса необходимы экспериментальные данные, например, изменение концентрации ацетона во времени и константы скорости при двух температурах.
Кинетика каталитического окисления ацетона при температуре 490˚С
K(530˚С)/k(490˚С) = 2,1
| τ, с | ||||||||
| С, моль/м3 | 1,94 | 0,738 | 0,481 | 0,374 | 0,313 | 0,203 | 0,158 | |
| lnC | 2,3 | 0,66 | -0,3 | -0,73 | -0,98 | -1,16 | -1,59 | -1,85 |
| 1/C | 0,1 | 0,52 | 1,36 | 2,08 | 2,67 | 3,19 | 4,93 | 6,33 |
Изменение константы скорости реакции при увеличении температуры
| t1, ˚С | t2, ˚С | К2/К1 |
| 2,1 |
Целочисленный порядок реакции удобно определить графическим методом. Для этого интегрируем кинетическое уравнение при n = 0; 1 и 2 (пределы интегрирования 0- τ и С0 -С)
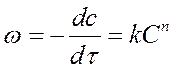
n = 0; -dc/dτ; С = С0 – kτ;
n = 1; -dc/dτ = kC; lnС = lnС0 – kτ;
n = 2; -dc/dτ = kC2; 1/С = 1/С0 – kτ;
Таким образом, имеем линейные уравнения при y =С; lnC или 1/С; х = τ. Если реакция протекает, например, по первому порядку, то экспериментальные данные должны дать линейный график в координатах lnC = f(τ), в других координатах получится криволинейная зависимость. Для этого дополняем таблицу строками lnC и 1/С и строим кинетические кривые в функциональных координатах уравнений.
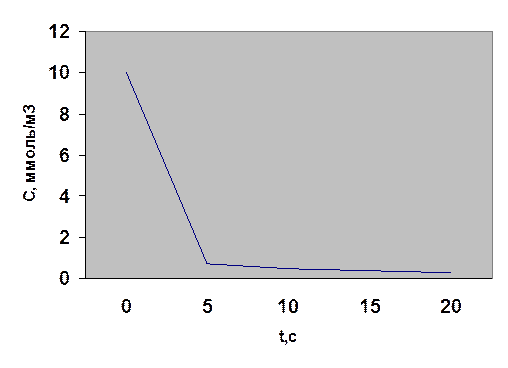
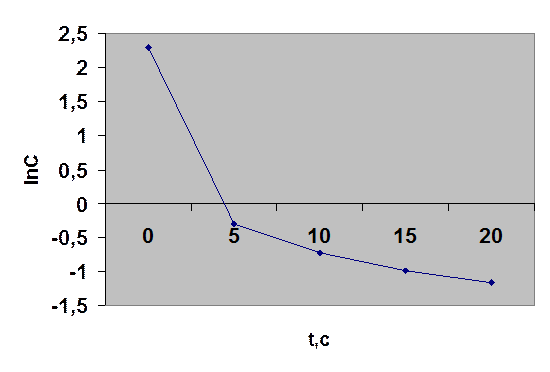

Как видно, экспериментальные данные не подчиняются кинетическим уравнениям 0-, 1- и 2-го порядков. Вероятно, в данном случае порядок имеет дробную величину. В связи с этим применим дифференциальный метод анализа, который заключается в том, что при логарифмировании уравнения ω = k1 · Cn1ац = k1 · Сn2О2
lnw = lnk + nlnC
получается линейная зависимость lnw от lnC, а угловой коэффициент при этом равен n и отрезок отсекаемый на оси lnw равен lnk.
Скорость реакции вычисляем графическим дифференцированием кинетической кривой. Для этого разбиваем ось времени на одинаковые участки по ∆τ = 5 с и измеряем ∆С на каждом участке. Тогда заменяя криволинейную зависимость на каждом участке на линейную, получаем значения средней скорости реакции в пределах выбранных концентраций
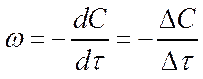
Данные сводим в таблицу.
Определение порядка и константы скорости реакции окисления ацетона
| τ, с | ||||||||
| С, моль/м3 | 0,738 | 0,481 | 0,374 | 0,313 | ||||
| ∆С, моль/м3 | - | 9,262 | 0,257 | 0,107 | 0,061 | |||
| W=(∆С/ ∆τ)·102 | 185,24 | 5,04 | 2,14 | 1,22 | ||||
| СCp, моль/м3 | 5,369 | 0,6095 | 0,4275 | 0,3435 | ||||
| lnw | 5,22 | 1,62 | 0,76 | 0,199 | ||||
| ln СCp | 1,68 | -0,495 | -0,85 | -1,614 | ||||
| k·103 | ||||||||
Затем рассчитываем на каждом участке ССр = (Ci+1 - Ci)/2 и строим зависимость lnw = f (lnCСр). Наилучшим способом проводим прямую линию, отвечающую уравнению lnw = lnk + nlnC. Кинетический порядок реакции равен тангенсу угла наклона прямой.
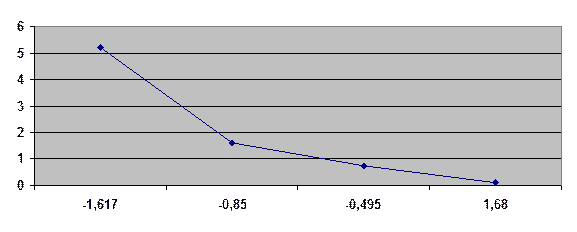
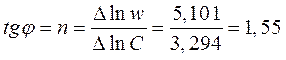
Среднюю константу скорости реакции определяем, экстраполируя кривую к lnC = 0
lnk = 0,6
k = 1,81
Таким образом, кинетическое уравнение в данном случае можно записать:
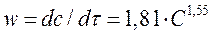
Или после интегрирования этого уравнения получаем:
Из последнего уравнения рассчитываем константу скорости для заданных концентраций и времен k = и результаты вносим в таблицу. Средняя константа скорости равна
Что практически совпадает с измеренной графическим методом. Температурную зависимость скорости реакции передает уравнение Аррениуса:
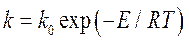
Где k0 – предэкспоненциальный множитель; Е – энергия активации.
Экспериментальные данные позволяют рассчитать эти константы. Для этого логарифмируем и записываем уравнение Аррениуса для двух заданных температур:
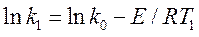
Вычитаем первое уравнение из второго и вычисляем энергию активации
Рассчитываем предэкспоненциальный множитель
Большая величина Е показывает, что реакция протекает в кинетической области, т. к. для диффузионной области энергия активации не превышает 20 кДж/моль.
Энергия активации и предэкспонента в теории абсолютных скоростей реакции связаны с энтропией и энтальпией переходного состояния
Тогда энергия Гиббса образования переходного состояния равна
Таким образом, выполненные действия позволяют проводить расчет скорости процесса на выбранном катализаторе при заданных исходных концентрациях компонента и температурах, так как порядок реакции, энтропия переходного состояния и энергия активации не зависят от концентрации и температуры:
Задание 3.3 Адсорбционная очистка вентиляционных газов от вещества А (ацетона) и выделение его в чистом виде методом ректификации
1. См. разд. 3.1.
2. Вентиляционные газы очищаются от вещества А методом адсорбции при температуре 25˚ с использованием активного угля СКТ. Максимальная температура адсорбера t2 =35˚C, минимальная t1 =-15˚C. Адсорбция- экзотермический процесс, поэтому, чтобы снизить температуру в адсорбере вентиляционные газы разбавляют воздухом в 2 раза.
2.1. Дать характеристику адсорбционного метода очистки газов
2.2. Рассчитать процесс адсорбции.
3. Десорбция вещества А (С2Н4О2) водяным паром позволила получить раствор с концентрацией хн = 0,10 в количестве Gн= 1000 кг. Методом ректификации при давлении Р получены дистиллят и кубовый остаток с концентрациями хД =0,005 и хК = 0,95 соответственно.
3.1. Дать характеристику метода ректификации.
3.2. Рассчитать процесс ректификации.
4. Низкоконцентрированный раствор разбавляется другими сточными водами в 10 раз и направляется на биологическую очистку.
4.1. Дать характеристику биохимической очистке сточных вод.
4.2. Рассчитать кинетику процесса (принять порядок реакции n=1)
4.3. Дать прогноз изменения времени процесса при колебаниях температуры ±5˚ С и увеличении концентрации сточных вод в 10 раз.
| К1, ч-1 | 0,13 |
| K2/K1 | 3,0 |
| t1,˚C | |
| t2,˚C |
2.1. Адсорбционный метод очистки газов
Абсорбционный метод – скрубберный метод, заключается в разделении газовоздушной смеси на составные части путём поглощения одного или нескольких газовых компонентов (абсорбатов) этой смеси жидким поглотителем (абсорбентом) с образованием раствора. Решающим условием при выборе абсорбента является растворимость в нём извлекаемого компонента и её зависимость от t° и p. Хорошо растворимыми называются газы, которые при 0 °С, 101,3 кПа растворяются в количество сотни граммов на 1кг растворителя. Таким образом, удаляют NH3, HF, HCl используя в качестве поглотителя просто воду.
Метод хемосорбции основан на поглощении газов и паров твёрдыми или жидкими поглотителями с образованием мало летучих или малорастворимых химических соединений. Обычно это экзотермические процессы и обратимые, поэтому при > t° раствора образующееся химические соединения разлагается с выделением исходных элементов. Примером служит очистка газов от H2S с применением мышьяковощелочного, этаноламинового и др. растворов, очистка газов от оксидов азота с помощью известкового раствора. Эти методы называются мокрыми.
Абсорбционные методы очистки отходящих газов подразделяют по следующим признакам:
- по абсорбируемому компоненту
- по типу применяемого абсорбента
- по характеру процесса – с циркуляцией и без циркуляции газа
- по использованию абсорбента - регенерацией и возвращением его в цикл(циклические) и без регенерации(не циклические)
- по использованию улавливаемых компонентов с рекуперацией и без рекуперации
- по типу рекуперируемого продукта
- по организации процесса – периодические и непрерывные
- по конструктивным типам абсорбционной аппаратуры
Выбор метода очистки зависит от многих факторов: концентрации, объёма и t° газа, примесей и т. д.
Адсорбционные методы очистки газов используют для удаления из них газообразных и парообразных примесей в адсорберах.
Достоинство метода – это высокая степень очистки, а недостаток – невозможность очистки запылённых газов.
В качестве адсорбентов или поглотителей применяют вещества, имеющие большую площадь поверхности на единицу массы. Например, поверхность активированных углей 105 -106 м2/кг. Их применяют для очистки газов от органических паров, удаления неприятных запахов и газообразных примесей, содержащихся в промышленных выбросах. В качестве адсорбентов используются глинозём, силикагель, Al2O3, синтетические цеолиты или молекулярные сита.
Адсорбцию широко используют при удалении паров растворителя из отработанного воздуха при окраске автомобилей органических смол и паров растворителей, при производстве стеклотканей, а также паров эфира, ацетона и др. растворителей, в производстве нитроцеллюлозы и бездымного пороха, для очистки выхлопных газов автомобилей; для удаления ядовитых компонентов (H2S); для удаления радиоактивных газов и т. д.
2.2. Характеристика системы и её параметры:

 Газовоздушный Рац = Рраб = 1240 Па T= 298 К раствор ацетона V0 = 73 см3/моль
Газовоздушный Рац = Рраб = 1240 Па T= 298 К раствор ацетона V0 = 73 см3/моль
Ацетон (ж) в W0 = 0,44 см3/г
адсорбенте E0 = 21,5 кДж/моль
P0298 = 259 Торр = 34530 Па
Реальные не идеальные системы удовлетворительно описываются термическим уравнением теории объемного заполнения микропор (ТОЗМ)
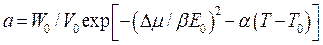
Где а – величина адсорбции, моль/г; W0 – параметр адсорбента – объем микропор, см3/г; V0 – мольный объем адсорбата, см3/моль; Е0 – параметр адсорбента – характеристическая энергия адсорбции бензола; β – коэффициент подобия; α – термический коэффициент адсорбции, К-1; Т – температура адсорбции; Т0 = 298 К и
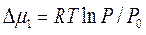
-изменение химического потенциала сорбтива при адсорбции.
Пусть очистку ГВВ от паров ацетона производят в адсорбере, заполненном микропористым (радиус пор равен 13/Е0 = 13/21,5 = 0,6 нм) активным углем СКТ. Рабочее давление ацетона Рраб = 1240 Па, давление насыщенного пара Р0 = Р0298 = 259 Торр = 34530 Па. Тогда изменение химического потенциала при адсорбции будет равно:

Коэффициент подобия равен отношению парахоров ацетона и бензола:
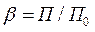
Парахор бензола равен П0 = 205,4. Для ацетона парахор рассчитываем как сумму парахоров атомов С3Н6О:
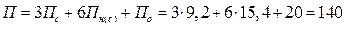
Тогда β =140/205,4 = 0,68.
Термический коэффициент сорбции вычисляем по уравнениям:
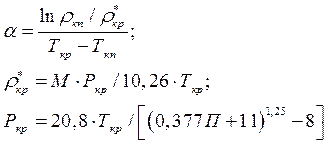
Где ρкп, ρкр* - плотность ацетона при температурах кипения (Ткп) и критической (Ткр).
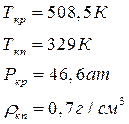
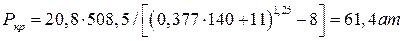
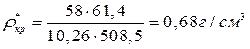
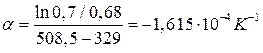
Рассчитываем величину адсорбции (согласно термическому уравнению ТОМЗ) при рабочем давлении и Т = 298 К.
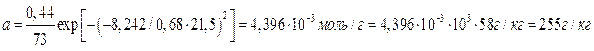
Адсорберы обычно располагают на открытом воздухе или в неотапливаемых помещениях, а величина адсорбции существенно зависит от температуры, что учитывает термическое уравнение ТОМЗ через термический коэффициент адсорбции α. Вычислим величину адсорбции для максимальной (t˚= 35˚C) и минимальной (t˚= -15˚C) температур. Однако давление насыщенного пара Р0 также зависит от температуры. Для его расчета воспользуемся следствием из уравнения Клаузиса-Клапейрона:
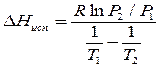
Рассчитав ∆Нисп можно вычислить давление насыщенного пара при любой температуре (при допущении, что ∆Нисп не зависит от температуры):
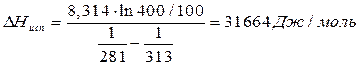
Вычисляем Р0Т через Р0298 = 34530 Па, и изменение химического потенциала:
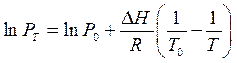
При минимальной температуре: Т = -15 +273 = 258 К
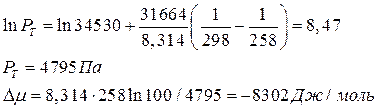
При максимальной температуре: Т = 35 +273 = 308 К
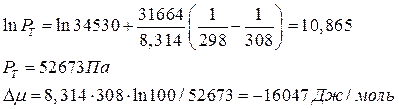
Теперь можно рассчитать величину адсорбции
-при минимальной температуре:

-при максимальной температуре:

После улавливания паров ацетона активным углем адсорбат удаляют из угля нагреванием с помощью водяного пара, последний выходит из адсорбера в смеси с парами ацетона и конденсируется. Обычно расход водяного пара составляет 2-5 кг на кг адсорбата. Концентрацию полученного раствора ацетона в воде можно увеличить методом ректификации.
|
|
|
|
|
Дата добавления: 2015-06-28; Просмотров: 1536; Нарушение авторских прав?; Мы поможем в написании вашей работы!