
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обратный осмос
|
|
|
|
Осмотическое давление, возникающее при диффузионном процессе самопроизвольного перехода растворителя через разделительную полупроницаемую мембрану в область более концентрированного раствора, называют осмосом. Обратный осмос - процесс мембранного разделения жидких растворов методом преимущественного проникания через полупроницаемую мембрану растворителя под действием приложенного к раствору давления, превышающего его осмотическое давление. Осмос - самопроизвольный переход растворителя через полупроницаемую перегородку в раствор.
Обратный осмос употребляют для разделения растворов без фазовых перевоплощений. Растворитель диффундирует через мембрану, а растворенное вещество задерживается. Как и при ультрафильтрации, при обратном осмосе не требуется повышения температуры и химического действия.
Процесс обратного осмоса различается от ультрафильтрации областью внедрения и аппаратами. Недочеты способа обратного осмоса - процессы концентрационной поляризации и завышенное требование к уплотняющим устройствам аппаратов. Для удаления концентрационного слоя употребляют разные устройства, турбулизирующие сгусток ближней зоны раствора у мембраны. При обратном осмосе размер молекул отделяемого растворителя соизмерим с размером молекул вещества в растворе (при ультрафильтрации различие было значимым).
Существенным преимуществом обратного осмоса перед всеми другими способами очистки сточных вод является одновременная очистка от неорганических и органических примесей, что в особенности принципиально в системах оборотного водоснабжения. Обеспечивается возможность получения более незапятанной воды, так как мембраны могут задерживать фактически все растворенные вещества и взвеси минерального и органического характера, в том числе вирусов, микробов, микробов и т.Д. Такую очистку воды в настоящее время обширно используют при водоподготовке для промышленных целей.
Характерные требования, предъявляемые к обратимосмотическим мембранам - высокие проницаемости и селективность, а также способность противостоять значимой разности давления по обеим сторонам мембраны. Свойства разных мембран приведены в таблице.
Таблица 16. черта ацетатцеллюлозных мембран разных типов
| Показатель | МГА-80 | МГА-90 | МГА-95 | МГА-100 |
| Дефектность в структуре | - | - | Отсутствие поперечных и долевых полос | |
| общественная пористость,% | 75±3 | 75±3 | 75±3 | 75±3 |
| Водопроницаемость при давлении 5 МПа, л/(м2.сут), не менее | ||||
| Солезадержание, %, не менее | 97,5 |
кроме уплотняющихся мембран из разных полимеров употребляют мембраны с твердой структурой, полученные плазменной полимеризацией. Их способность - стабильное увеличение селективности и проницаемости в течение долгого времени (первые 6-8 сут), хорошие свойства при сравнимо высокой концентрации исходного раствора. К мембранам с твердой структурой относятся металлические, из пористого стекла, динамические и др. Огромное развитие получают динамические мембраны.
На установках обратного осмоса используют предварительную фильтрацию исходной воды от жестких частиц и загрязнений. Количества концентрата составляет традиционно 25-50% от количества поступающего раствора.
2.2. Осмотическое давление равно:
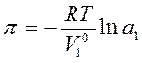
Где V10 – мольный объем воды; а1 = γ1·х1 – активность воды; γ1 – коэффициент активности.
Примем коэффициент активности равным 1. Тогда а1 = х1= 1- х2, подставляя в уравнение получаем:

Где х2 – мольная доля масляной кислоты в водном растворе. Для предельно разбавленного раствора уравнение упрощается:

Где С – молярность раствора масляной кислоты (моль/м3)
Получен раствор с концентрацией хаб = 0,978% (Саб = 0,51 моль/л = 0,51·103 моль/м3). Осмотическое давление такого раствора определим в приближении бесконечно разбавленного и идеального раствора

Вычислим мольный объем воды через её плотность d=1 г/см3:
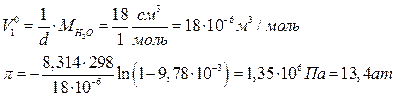
Так как концентрация достаточно велика, то получилось некоторое расхождение в результатах по двум уравнениям.
Произведем концентрирование этого раствора до такой концентрации, при которой раствор можно повторно использовать в производстве или будет экономически целесообразно разделить его на компоненты, например ректификацией. Примем эту концентрацию равной хн = 0,11. При такой концентрации осмотическое давление будет равно

Рассчитаем материальные потоки, если необходимо получить Gн = 150 кг концентрированного раствора. В точном расчете необходимо учесть селективность мембраны, здесь для упрощения принята 100% селективность, т. е. через мембрану проходит чистая вода и концентрация масляной кислоты в ней хв = 0.
Целесообразно массу раствора Gн представить в молях, для этого рассчитываем среднюю молекулярную массу раствора с хн = 0,11

Общий материальный баланс:
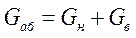
Баланс по МК:
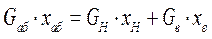
Тогда:

Задание 3.6. Разделение растворов электролитов
1. Выделить из разбавленного раствора кристаллы вещества А (AgNO3), если количество раствора Ga = 400 кг, начальная концентрация равна ma = 5 (г/1000г Н2О), температура вымораживания растворителя ta = -3˚C, концентрация раствора, подаваемого на кристаллизацию при температуре tкр = 10˚C, равна mв = 7000.
1.1. Дать характеристики процессов вымораживания, выпаривания растворителей и кристаллизации растворенного вещества, рассчитать материальные потоки.
Изобразить на диаграмме состояния процессы, перечисленные в п. 1.1.
2. Как изменится процесс разделения, если произвести начальное концентрирование раствора методом обратного осмоса при давлении π =100 атм.
2.1. Дать характеристику мембранных процессов.
2.2. Рассчитать процесс обратноосмотического концентрирования раствора.
Решение:
Рассмотрим, как можно выделить нитрат серебра из разбавленного раствора с концентрацией ma = 5 (г/1000г Н2О), находящегося при начальной температуре tкр = 10˚C. Строим фазовую диаграмму состояния системы AgNO3 – H2O.
| m | |||||||||
| tкрист | -2 | -3,5 | -7,19 | ||||||
| tкип | 103,5 | (105) | (108) | (111) | (114) | (115) |
 Концентрирование исходного раствора методом вымораживания растворителя.
Концентрирование исходного раствора методом вымораживания растворителя.
Сточные воды в большинстве своем имеют очень низкую концентрацию. Поэтому, если ставить цель выделить из них ценный или вредный компонент, то первой операцией должно быть концентрирование раствора. Это может быть достигнуто тремя путями: обратным осмосом, выпаркой и вымораживанием растворителя. Последний упомянутый метод связан с тем, что при концентрациях ниже эвтектической при охлаждении раствора из него кристаллизуется только растворитель, а концентрация раствора повышается вдоль линии ликвидуса. Метод вымораживания растворителя в отечественной технологии кристаллизации применяется редко, вероятно из-за низкого уровня развития холодильной техники.
Если в отстойнике сточные воды имеют ПДК или близкую к ним концентрацию, то замерзание отстойника в зимнее время ведет к вымораживанию растворителя и возможному повышению ПДК в десятки раз.
Охладим исходный разбавленный раствор (точка а), тогда в точке в начнут выделяться кристаллы воды. Температуру начала кристаллизации воды определяем по криоскопической формуле:

Для этого вычисляем входящие в неё величины. Нитрат серебра – сильный электролит:
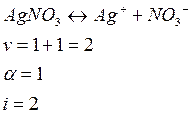
Молярность раствора:

Криоскопическая константа для воды
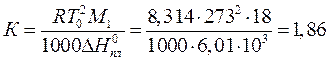
Где Т0 = 273 К – температура кристаллизации воды; М1 – молекулярная масса воды; ∆Н0пл – энтальпия плавления льда, Дж/моль.
Таким образом,
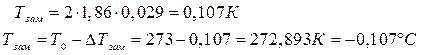
При дальнейшем охлаждении раствора до заданной температуры ta = -3˚С из него будут выделятся кристаллы воды (лед), а концентрация раствора будет увеличиваться по линии ликвидуса bdE и в точке d достигнет md = 377 г/кг = 377/170 = 2,2 моль/кг.
Пусть на концентрирование поступает Ga= 400 кг раствора AgNO3, переводим рабочие концентрации в массовые доли г/кг раствора:

Тогда схема материальных потоков будет:

Исходный
раствор
Ga=400 кг
ωа = 4,975 г/кг
 |  |


Лед Конц. раствор
Gл, ωл = 0. Gd, ωd = 273,78 г/кг
Общий материальный баланс:

Материальный баланс по AgNO3

Тогда

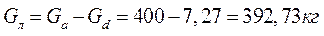
Таким образом, методом вымораживания растворителя масса сточных вод снизилась с 400 кг до 7 кг, а концентрация их повысилась в 298,78/4,975= 60 раз.
Концентрирование исходного раствора методом обратного осмоса
Рассмотренный тепло-массообменный процесс концентрирования разбавленного раствора требует затраты большого количества энергии, более экономичными являются мембранные процессы. Осмотическое давление разбавленного раствора AgNO3 можно вычислить по формуле:

При этом концентрация (С) должна быть отнесена к 1 м3 раствора. Принимая плотность раствора равной плотности воды, получаем:
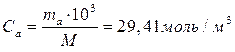
Тогда при температуре Т = 283К

Осмотическое давление концентрированного раствора (md=377г/кг) нельзя рассчитать по такому уравнению, так как введенные упрощения при его выводе корректны только для бесконечно разбавленного раствора. Для раствора любой концентрации в приближении идеального раствора:

Где V01 = 18·10-6 м3/моль – мольный объем воды; x2 – мольная доля AgNO3 в растворе

Тогда:
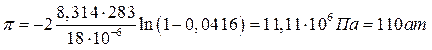
Схему материальных потоков при обратноосмотическом разделении раствора можно представить в следующем виде:





















 Ga, ωa Gd, ωd Концентрат
Ga, ωa Gd, ωd Концентрат
 Мембрана
Мембрана
Исходный
раствор
Вода Gл, ωл
Концентрирование раствора AgNO3 методом испарения растворителя (выпаривание)
Полученный после вымораживания или мембранного разделения раствор в количестве Gd = 7,27 кг с концентрацией md =377 г/кг направим на выпаривание. Для этого по линии нагреваем раствор до температуры кипения te. Приближенно эту температуру можно вычислить по эбулоскопической формуле.
Эбулоскопическая константа равна:

Где ∆Н0исп = 40630 Дж/моль – энтальпия испарения воды при температуре кипения Т0 = 373 К
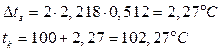
Эта температура несколько ниже экспериментальной величины tв = 101,33˚С, приведенной на графике.
При выпаривании концентрация раствора и температура кипения возрастают по линии еf. В точке f температура кипения составляет 12,5˚ и концентрация раствора достигает заданной величины mf = 7000 г/кг растворителя.
Составляем схему материальных потоков и рассчитываем количества концентрированного раствора Gf и пара:

Исходный раствор
Gd = 7,27 кг
ωd = 273 г/кг
 |  |


Пар Концентрат
W, ωn = 0 Gf; ωf = 0,875
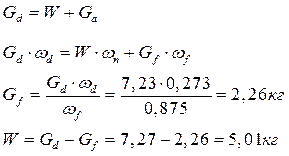
Кристаллизация AgNO3 из концентрированного раствор
Полученный после выпаривания концентрированный раствор AgNO3 в количестве Gf=2,26 кг с концентрацией ωf = 0,875 (mf = 7000 г/кг Н2О) при охлаждении становится насыщенным. Дальнейшее его охлаждение по линии hg сопровождается кристаллизацией AgNO3, а концентрация раствора соответственно понижается по линии ликвидуса hlE. Если кристаллизацию проводить при температуре tg = 10˚C то конечную концентрацию маточного насыщенного раствора найдем на пересечении изотермы (10˚C) и линии ликвидуса: ml = 1740 г/кг
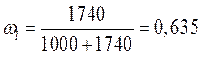
Составим схему материальных потоков и вычислим количества выделенных кристаллов AgNO3 и маточного раствора

Концентрат
Gf=2,26 кг
ωf = 0,875
 |  |


Кристаллы Маточный раствор
Gкр, ωкр = 1 Gl, ωl = 0,635
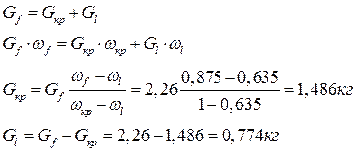
Маточный раствор можно добавить к раствору, полученному после вымораживания и направить на выпаривание. Тогда на выпаривание будет направлено G кг раствора с концентрацией ω.


Gd = 7,27 кг Gl= 0,774 кг

 ωd = 0,273 ωl = 0,635
ωd = 0,273 ωl = 0,635

G = 7,81кг
ω = 0,287

Таким образом, в результате проведенных операций из исходного раствора Ga = 400кг (ωа = 4,975) получен чистый растворитель в виде льда Gл =392,73 кг и пара W = 5,01 кг и кристаллы AgNO3 Gкр =7,27 кг.
В последнем процессе при кристаллизации AgNO3 необходимо отводить теплоту кристаллизации. Мольную теплоту кристаллизации можно определить по приближенному уравнению
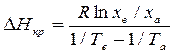
Где ха, хв - концентрации (мольные доли) насыщенного раствора при температурах Та и Тв. Для AgNO3 находим параметры насыщенных растворов при температурах, близких к выбранной температуре кристаллизации: ma = 2000 г/кг, ta =15˚С; mв = 1220 г/кг, tв =0˚С.
Переводим концентрации mi раствора в мольные доли:


И подставляем их в уравнение:

|
|
|
|
|
Дата добавления: 2015-06-28; Просмотров: 751; Нарушение авторских прав?; Мы поможем в написании вашей работы!