
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы электролиза
Количественные величины электрохимического процесса были получены в 30-х годах XIX века английским физиком Фарадеем, кото-рый установил законы электролиза. В соответствии с этими законами масса образующегося при электролизе вещества определяется из уравнения
 ,
,
где  − коэффициент пропорциональности, который называют электрохимическим эквивалентом, г/Кл (г/А∙ч);
− коэффициент пропорциональности, который называют электрохимическим эквивалентом, г/Кл (г/А∙ч);
 − количество электричества, израсходованное при электро-лизе, Кл(А•ч);
− количество электричества, израсходованное при электро-лизе, Кл(А•ч);
I − сила тока электролиза, А;
τ− время электролиза, с (ч).
Электрохимический эквивалент рассчитывают по формуле, Г/Кл(Г/А•ч),
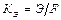 ,
,
где Э − химический эквивалент или молярная масса эквивалента веще-ства, г/моль-экв;
F − константа Фарадея (F = 96500 Кл/моль-экв или 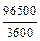 =
=
= 26,8 А-ч/моль-экв).
Следовательно, электрохимический эквивалент − это количество граммов металла, которое осаждается при протекании единицы коли-чества электричества (Кл или А∙ч).
Химический эквивалент (молярная масса эквивалента) вычисля-ется из соотношения

где М − молярная масса металла, используемого для покрытия, г/моль;
z − число электронов или заряд ионов металла, участвующих в электрохимической реакции (число молей эквивалентов в молекуле вещества).
Если равенства, приведенные выше, объединить, то уравнение для расчета массы металла, осажденного при электролизе, примет вид
 (1)
(1)
где  − теоретическая масса металла, которая должна выделиться при электролизе, г.
− теоретическая масса металла, которая должна выделиться при электролизе, г.
Законы электролиза Фарадея являются наиболее общими и точны-ми количественными законами электрохимии. Однако в большинстве случаев электрохимическому превращению подвергается меньшее количество вещества, чем дают вычисления по формуле (1). Связано это с тем, что, например, часть осажденного металла осыпается с электрода (катода), растворяется в электролите. Происходит совместный разряд ионов основного металла и побочных продуктов. Часть электричества теряется на нагрев электролита. Чтобы учесть влияние потерь электричества на получение основного металла при электролизе, введено понятие выхода по току, %,
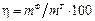 ,
,
где  − фактическая (действительная) масса металла, образовавшегося при электролизе, г.
− фактическая (действительная) масса металла, образовавшегося при электролизе, г.
Если объем осажденного металла равномерно распределить по поверхности покрываемой детали, то можно получить толщину метал-лического покрытия
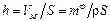 ,
,
где  − объём металла;
− объём металла;
S − поверхность детали;
ρ − плотность металла, используемого для покрытия.
После подстановки в формулу величин, характеризующих процесс электролиза, уравнение для вычисления толщины металлического по-крытия приобретет вид (в мм)

или
 ,
,
где  − электрохимический эквивалент, г/А∙ч;
− электрохимический эквивалент, г/А∙ч;
i − катодная плотность тока (i = I / S), А/дм2;
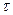 − время электролиза, ч;
− время электролиза, ч;
η − выход по току, %;
ρ−плотность металла покрытия, г/см3.
Распределение тока по поверхности катода не бывает равномер-ным. Это приводит к разной скорости осаждения и, следовательно,
толщине покрытия. Способность ванны давать равномерные по толщине покрытия на рельефной поверхности называется рассеивающей способностью. Рассеивающую способность электролита увеличивают ПАВ и одновременно они обладают большой способностью к комплексообра-зованию, что ещё в большей степени повышает рассеивающую способ-ность электролита.
|
|
Дата добавления: 2015-06-28; Просмотров: 378; Нарушение авторских прав?; Мы поможем в написании вашей работы!