
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Необходимые материалы и приборы
|
|
|
|
КОНТРОЛЬНЫЕ ВОПРОСЫ
Содержание отчета по работе
Обработка результатов экспериментов
После проведения экспериментов вычислить массу осажденного металла на каждом образце, теоретическую и действительную, выход по току, толщину покрытия по соответствующим формулам. Построить график выход по току − время электролиза. Все результаты расчетов свести в таблицу 1.
Толщину цинкового покрытия можно определить капельным ме-тодом. При этом применяют раствор, содержащий 200 г KI и 100 г I в одном литре воды. Одна капля раствора в течение одной минуты рас-творяет при 15 °С − 1,01·10 -3 мм; при 20 °С − 1,24 10 -3 мм; при 25 °С − 1,45 10-3 мм.
Из капельницы наносят на образец одну каплю раствора и по се-кундомеру отмечают время. По истечении одной минуты каплю сни-мают, промокая ее фильтровальной бумагой, и на то же место наносят вторую каплю раствора. И так до тех пор, пока не обнаружится участок основного металла, равный по величине половине поверхности, зани-маемой каплей.
Таблица 1 − результаты опытов
| Показатели испытаний | Номер образца | |||
| Материал образцов | ||||
| Полная поверхность образцов, см2 | ||||
| Масса образцов: начальная, г после обезжирования, г после покрытия, г | ||||
| Осаждаемый металл | ||||
| Режимы электролиза: сила тока, А катодная плотность тока, А/дм2 напряжение, В температура электролиза, °С время электролиза, мин | ||||
| Масса осаждаемого металла: mФ, г mТ, г | ||||
| Выход по току металла покрытия, % | ||||
| Толщина покрытия: по расчету, мм по капельному методу, мм |
По общему числу капель определяют толщину слоя. Средний ре-зультат из трех определений заносят в таблицу 1.
В отчет по проделанной работе нужно привести цель работы, краткую теоретическую часть, результаты экспериментов и их обработку в соответствии с методическими рекомендациями.
Цель работы должна отражать экспериментальный метод (методику) проведения опытов, величины, которые следует определить.
В теоретической части необходимо привести основные понятия и определения о термодинамических свойствах растворов, парциальных молярных величинах компонентов растворов, от каких факторов
они зависят. Описать методы определения парциальных молярных
величин. Привести формулы, которые будут необходимы при обработке результатов экспериментов. Содержание теоретической части должно быть ответами на контрольные вопросы по выполняемой работе.
Экспериментальные данные оформлять в соответствии с методическими рекомендациями. Сначала проводятся черновые расчеты по обработке данных экспериментов. После проверки их правильности преподавателем они заносятся в отчет. Все полученные величины приводить с указанием размерности. Таблицы и графики выполнять аккуратно с помощью карандаша (ручки) и линейки.
Отчет пишется на листах А4 или на развернутых листах тетрадной бумаги. В отчете не должно быть исправлений, зачеркиваний текста и вычислений.
По данным, полученным в работе, необходимо сделать выводы. В них следует отразить, какой метод использовался в работе, какие получены экспериментальные величины.
Небрежно оформленный отчет не принимается.
2.5 Удаление некачественных цинковых, медных
и никелевых покрытий
Цинк с поверхности стальных изделий может быть удален растворением в 5−10 %-ной соляной или серной кислоте при комнатной температуре. Чтобы уменьшить степень растворения стали, в раствор добавляют окись сурьмы или хлорид сурьмы (от 3 до 5 г/л). Для растворения цинка можно использовать 10−15 %-ный раствор щелочи.
Медные покрытия или медные слои, нанесённые перед штамповкой или прокаткой, можно удалять химическим растворением в растворе, содержащем 250 г/л хромового ангидрида (СгО3) и от 100 до
200 г/л сернокислого аммония или от 2 до 4 г/л серной кислоты, или электрохимическим путем, помещая их в качестве анодов в 10−30 %-ный раствор цианидов (плотность тока ~ 1 А/дм2) или в 10 %-ный раствор нитрата натрия (NaNО3).
С алюминиевых деталей удаление меди можно производить, кроме указанных выше способов, растворением её в растворе азотной кислоты с концентрацией от 300 до 600 г/л.
Никелевые покрытия удаляют со стальных, медных и латунных деталей электрохимическим растворением никеля в растворе серной кислоты (плотность 1,74 г/см3), в который добавляют 10 г/л глицерина. Анодная плотность тока от 3 до 8 А/дм2, температура раствора от 18 до 25 °С. Катоды − свинец. Рекомендуется применение реверсивного
тока.
Никель со стальных деталей может быть удален также в растворе, содержащем от 300 до 400 г/л азотнокислого натрия, при анодной плотности тока до 10 А/дм2 и температуре 90 °С.
С деталей, отлитых под давлением из цинковых сплавов, никель удаляют в 50 %-ном растворе серной кислоты при плотности тока от
3 до 6 А/дм2 и температуре 60 °С.
3 ТЕХНИКА БЕЗОПАСНОСТИ И ПРАВИЛА ПОВЕДЕНИЯ
В ЛАБОРАТОРИИ ПРИ ВЫПОЛНЕНИИ РАБОТЫ
Лабораторная работа проводится в халате из хлопчатобумажной ткани для зашиты основной одежды от попадания растворов и в защитных очках.
Приступать к лабораторной работе можно после знакомства с методическими указаниями к ней, уяснения основных теоретических положений о процессе анодирования и методики проведения экспериментов, собеседования с преподавателем или инженером по контрольным вопросам работы и их разрешения выполнять работу.
Так как процесс анодирования проводят с использованием достаточно концентрированного раствора серной кислоты и электрического тока, то нужно соблюдать меры безопасной работы с растворами кислот и электрооборудованием. Перед включением установки убедиться в её исправности, проверить исправность токоподводящих проводов, вилки, розетки. О замеченных неисправностях сообщить преподавателю или инженеру (лаборанту). Не оставлять включенную установку без присмотра.
При заполнении стакана для анодирования соблюдать осто-рожность. Избегать разбрызгивания раствора кислоты, его попадания на кожу рук, ёмкость для анодирования должна находиться на защитном поддоне.
При проведении работы на лабораторном столе не должно быть посторонних предметов, кроме листа бумаги для записи результатов экспериментов. Во время выполнения работы нельзя отвлекаться посторонними делами и разговорами.
В лаборатории нельзя носить шорты, сандалии, босоножки.
Нельзя работать в лаборатории в ювелирных украшениях, широкополой одежде и с длинными распущенными волосами.
Контактные линзы нельзя носить в лаборатории, так как попавшие в них химреактивы могут вызвать серьезное повреждение глаз.
Не трогать в лаборатории установки, относящиеся к другим работам. Не портить мебель и приборы в лаборатории. Аккуратно обращаться со стеклянной посудой.
Делайте уборку рабочего места после окончания работы.
Мойте Ваши руки перед уходом из лаборатории.
1. Какие методы применяются для защиты металлов от коррозии?
2. Анодные и катодные металлические покрытия. Каков механизм их защитного действия?
3. Дать понятие об электрохимическом способе получения метал-лических покрытий. Привести формулы для количественных расчетов процесса электролиза.
4. Назвать основные операции подготовки поверхности перед нанесением металлических защитных покрытий.
5. Какова цель лабораторной работы и порядок её проведения?
6. Основные требования техники безопасности при выполнении работы.
1. Образцы в виде лопаток для покрытия. Размеры
покрываемой части − 60·40·2 мм − 4 шт.
2. Раствор для получения цинкового покрытия − 1 л
3. Раствор для получения медного покрытия − 1 л
4. Раствор для получения никелевого покрытия − 1 л
5. Цинковые аноды (размеры100·50·3 мм) − 2 шт.
6. Медные аноды (размеры 100·50·3 мм) − 2 шт.
7. Никелевые аноды (100·50·3 мм) − 2 шт.
8. Химический стакан на 500 см3 − 1 шт.
9. Наждачная бумага − лист 20.10 см
10. Фильтровальная бумага − лист 20 10 см
11. Штангенциркуль с ценой деления 0,1 или 0,05 мм − 1 шт.
12. Линейка с ценой деления 1 мм (длина 300 мм) − 1 шт.
13. Раствор для обезжиривания − 1 л
14. Раствор дня определения толщины цинкового покрытия 0,1 л
15. Раствор 15 %-ной H2SО4 для травления (декапирования) −1 л
16. Источник постоянного тока (U = 10−15 В) − 1 шт.
17. Реостат (R = 20 Om) −1 шт.
18. Амперметр на 2,5 А − 1 шт.
19. Вольтметр на 30 В − 1 шт.
20. Поддон (500·400 мм) − 1шт.
21. Раствор 15 %-ной HCI длятравления −1л
|
Для электрохимического способа получения металлических по-крытий на трёх образцах из стали провести следующие расчеты:
1. Определить расчетом массустальных образцов в зависимости от их размеров. Плотность стали принять равной ρ СТ =7,8 г/см3.
2. Рассчитать массу образцов после электрохимического обез-жиривания при заданной анодной плотности тока и времени обезжири-вания.
3. Вычислить действительную массу осажденного металла (Zn или Cu) на образцах по параметрам электролиза, если выход по току η = 65 % для Zn и η= 95 % для Cu.
4. Рассчитать массу стальных образцов с осажденным металлом для каждого времени электролиза.
5. Вычистить толщину металлического покрытия на образцах при разных временах электролиза.
6. Результаты расчетов по пунктам 1−5 занести в таблицу 1.
7. Построить график в координатах толщина покрытия h на образцах − время электролиза τ.
8. Найти время электролиза, достаточное для получения толщины металлического покрытия 0,05 мм (для Zn, обеспечивающего защиту стали от атмосферной коррозии, а дляCu − увеличение электропровод-ности стали).
9. Сделать вывод по выполненным расчетам.
Для проведения расчетов использовать данные вариантов зада- ний.
ВАРИАНТ № 1
Размеры стальных образцов: 50·50·1 мм.
Режимы электрохимического обезжиривания:
анодная плотность тока iA = 8 А/дм2;
время обезжиривания образцов: первого − 2; второго − 4; третьего − 6 мин.
Вид покрытия: цинковое.
Режимы электролиза:
катодная плотность тока iA = 5 А/дм2;
время обезжиривания τ образцов: первого − 10; второго − 20; третьего − 40 мин.
ВАРИАНТ № 2
Размеры стальных образцов: 60·40·1 мм.
Режимы электрохимического обезжиривания:
анодная плотность тока iA = 10 А/дм2;
время обезжиривания образцов: первого − 1; второго − 3; третьего − 5 мин.
Вид покрытия: медное.
Режимы электролиза:
катодная плотность тока iK = 4 А/дм2;
время электролиза τ образцов: первого − 15; второго − 30; третьего − 45 мин.
ВАРИАНТ № 3
Размеры стальных образцов: 55·40·2 мм.
Режимы электрохимического обезжиривания:
анодная плотность тока iА = 6 А/ дм2;
время обезжиривания образцов: первого − 1,5; второго − 3,5; третьего − 6 мин.
Вид покрытия: цинковое.
Режимы электролиза:
катодная плотность тока iK = 4 А/ дм2;
время электролиза  образцов: первого − 5, второго − 25; третьего − 40 мин.
образцов: первого − 5, второго − 25; третьего − 40 мин.
катодная плотность тока iK = 4 А/дм2;
время электролиза τ образцов: первого − 5; второго − 25; треть-
его − 40 мин.
ВАРИАНТ № 4
Размеры стальных образцов: 60·50·1 мм.
Режимы электрохимического обезжиривания:
анодная плотность тока U = 10 А/дм2;
время обезжиривания образцов: первого − 2: второго − 3; третье-
го − 4 мин.
Вид покрытия: медное.
Режимы электролиза:
катодная плотность тока iK = 5 А/дм2;
время электролиза 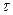 образцов: первого − 12; второго − 30; третьего − 50 мин.
образцов: первого − 12; второго − 30; третьего − 50 мин.
Характеристики осаждаемых металлов:
Zn: E 0Zn2+/Zn = -0,76 В, ρZn = 7,1 г/см3, М Zn = 65,4 г/моль;
Сu: E 0Cu2+/Cu = +0,34 В, ρCu = 8,96 г/см3; М Cu = 63,6 г/моль.
ЛИТЕРАТУРА
1. Методы зашиты металлов от коррозии: лабораторные работы № 6−8. − Тула: Тульский политехнический институт, кафедра химии. 1978.
2. Глинка, Н.Л. Общая химия / Н.Л. Глинка. − Л.: Химия. −1985. − С. 298.
3. Шлугер, М.А., Коррозия и защита металлов / М.А. Шлугер, Ф.Ф. Ожогин, Е.А. Ефимов. − М.: Металлургия, 1981. − С. 149.
4. Захарьев, Ю.В. Электрохимический способ нанесения защитных
металлических покрытий: методические указания к лабораторной ра-
боте по курсу «Коррозия химического оборудования» / Ю.В. Заха-рьев. − Бийск: БФ АПИ. 1990 (рукопись).
Учебное издание
Сакович Георгий Готфильдович
|
|
|
|
|
Дата добавления: 2015-06-28; Просмотров: 424; Нарушение авторских прав?; Мы поможем в написании вашей работы!