
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Испарение и конденсация
|
|
|
|
В жидких и твердых телах при любой температуре имеется некоторое количество молекул, энергия которых оказывается достаточной для того, чтобы преодолеть притяжение к другим молекулам, покинуть поверхность жидкости или твердого тела и перейти в газообразную фазу. Переход жидкости в газообразное состояние называется испарением, переход в газообразное состояние твердого тела носит название сублимации.
При испарении и сублимации тело покидают наиболее быстрые молекулы, вследствие чего средняя энергия оставшихся молекул уменьшается и тело охлаждается. Чтобы поддерживать температуру испаряющегося (или сублимирующегося) тела неизменной, к нему нужно непрерывно подводить тепло. Тепло q, которое необходимо сообщить единице массы вещества для того, чтобы превратить ее в пар, находящийся при той же температуре, какую имело вещество до испарения, называется удельной теплотой испарения (или сублимации).
При конденсации тепло, затраченное при испарении, отдается обратно: образующаяся при конденсации жидкость (или твердое тело) нагревается.
 Рассмотрим процесс установления равновесия между жидкостью и ее паром. Возьмем герметичный сосуд, частично заполненный жидкостью (рис.7.1), и допустим, что первоначально из пространства над жидкостью вещество было полностью удалено. Вследствие процесса испарения пространство над жидкостью станет наполняться молекулами. Молекулы, перешедшие в газообразную фазу, двигаясь хаотически, ударяются о поверхность жидкости, причем часть таких ударов будет сопровождаться переходом молекул в жидкую фазу. Количество молекул, переходящих в единицу времени в жидкую фазу, очевидно, пропорционально количеству ударяющихся о поверхность молекул, которое в свою очередь пропорционально
Рассмотрим процесс установления равновесия между жидкостью и ее паром. Возьмем герметичный сосуд, частично заполненный жидкостью (рис.7.1), и допустим, что первоначально из пространства над жидкостью вещество было полностью удалено. Вследствие процесса испарения пространство над жидкостью станет наполняться молекулами. Молекулы, перешедшие в газообразную фазу, двигаясь хаотически, ударяются о поверхность жидкости, причем часть таких ударов будет сопровождаться переходом молекул в жидкую фазу. Количество молекул, переходящих в единицу времени в жидкую фазу, очевидно, пропорционально количеству ударяющихся о поверхность молекул, которое в свою очередь пропорционально 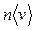 , т. е. растет с давлением р. Следовательно, наряду с испарением протекает обратный процесс перехода молекул из газообразной в жидкую фазу, причем интенсивность его растет по мере увеличения плотности молекул в пространстве над жидкостью. При достижении некоторого, вполне определенного (для данной температуры) давления количества молекул, покидающих жидкость и возвращающихся в нее, станут равны. Начиная с этого момента, плотность пара перестает изменяться. Между жидкостью и паром установится подвижное равновесие, которое будет существовать до тех пор, пока не изменится объем или температура системы. Пар, находящийся в равновесии со своей жидкостью, называется насыщенным. Давление, при котором наблюдается равновесие, называется давлением (или упругостью) насыщенного пара. Количество молекул, покидающих жидкость в единицу времени, растет с температурой.
, т. е. растет с давлением р. Следовательно, наряду с испарением протекает обратный процесс перехода молекул из газообразной в жидкую фазу, причем интенсивность его растет по мере увеличения плотности молекул в пространстве над жидкостью. При достижении некоторого, вполне определенного (для данной температуры) давления количества молекул, покидающих жидкость и возвращающихся в нее, станут равны. Начиная с этого момента, плотность пара перестает изменяться. Между жидкостью и паром установится подвижное равновесие, которое будет существовать до тех пор, пока не изменится объем или температура системы. Пар, находящийся в равновесии со своей жидкостью, называется насыщенным. Давление, при котором наблюдается равновесие, называется давлением (или упругостью) насыщенного пара. Количество молекул, покидающих жидкость в единицу времени, растет с температурой.
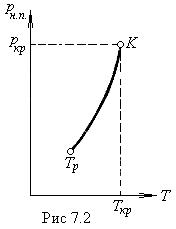 Количество молекул, ударяющихся о поверхность жидкости, зависит от температуры в меньшей степени (через
Количество молекул, ударяющихся о поверхность жидкости, зависит от температуры в меньшей степени (через 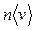 как
как 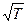 ). Поэтому при повышении температуры равновесие между фазами нарушается, и в течение некоторого времени поток молекул в направлении жидкость → пар будет превышать поток в направлении пар → жидкость. Это продолжается до тех пор, пока возрастание давления не приведет снова к установлению подвижного равновесия. Таким образом, давление, при котором устанавливается подвижное равновесие между жидкостью и паром, т. е. давление насыщенных паров, оказывается зависящим от температуры. Вид этой зависимости показан на рис.7.2.
). Поэтому при повышении температуры равновесие между фазами нарушается, и в течение некоторого времени поток молекул в направлении жидкость → пар будет превышать поток в направлении пар → жидкость. Это продолжается до тех пор, пока возрастание давления не приведет снова к установлению подвижного равновесия. Таким образом, давление, при котором устанавливается подвижное равновесие между жидкостью и паром, т. е. давление насыщенных паров, оказывается зависящим от температуры. Вид этой зависимости показан на рис.7.2.
Если увеличить объем сосуда, давление пара упадет и равновесие будет нарушено. В результате превратится в пар дополнительное количество жидкости такое, чтобы давление снова стало равным p н.п. Аналогично уменьшение объема приведет к превращению некоторого количества пара в жидкость.
7.3. Равновесие жидкости и насыщенного пара
|
|
|
|
|
|
|
|
|
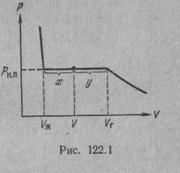
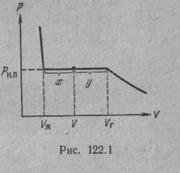
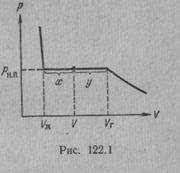
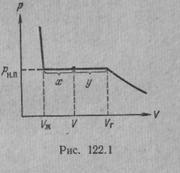
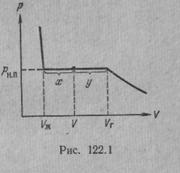
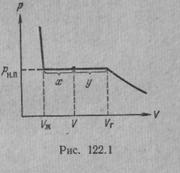
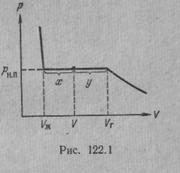
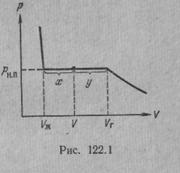
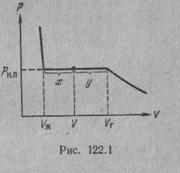
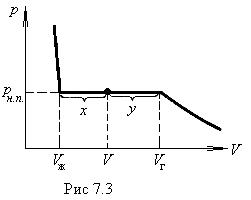 Рассмотрим процесс сжатия вещества при постоянной температуре. Первоначально вещество предполагается газообразным. Вначале по мере уменьшения объема давление газа будет расти (рис.7.3). По достижении объема V г давление перестает изменяться, а вещество перестает быть однородным — часть газа конденсируется в жидкость. Происходит расслоение вещества на две фазы: жидкую и газообразную. По мере дальнейшего уменьшения объема все большая часть вещества переходит в жидкую фазу, причем переход осуществляется при постоянном давлении p н.п (давлении насыщенного пара). После того как процесс конденсации вещества заканчивается (это происходит при достижении объема V ж), дальнейшее уменьшение объема начинает сопровождаться быстрым ростом давления.
Рассмотрим процесс сжатия вещества при постоянной температуре. Первоначально вещество предполагается газообразным. Вначале по мере уменьшения объема давление газа будет расти (рис.7.3). По достижении объема V г давление перестает изменяться, а вещество перестает быть однородным — часть газа конденсируется в жидкость. Происходит расслоение вещества на две фазы: жидкую и газообразную. По мере дальнейшего уменьшения объема все большая часть вещества переходит в жидкую фазу, причем переход осуществляется при постоянном давлении p н.п (давлении насыщенного пара). После того как процесс конденсации вещества заканчивается (это происходит при достижении объема V ж), дальнейшее уменьшение объема начинает сопровождаться быстрым ростом давления.
На рис.7.3 V г есть объем, занимаемый веществом в газообразном состоянии при давлении р н.п, V ж —объем вещества в жидком состоянии при том же давлении. При любом промежуточном значении объема V часть вещества с массой m ж будет находиться в жидком, а часть с массой т п — в парообразном состоянии. Найдем отношение т ж /т п.
Назовем удельным объемом 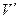 объем единицы массы вещества. Тогда, если масса вещества равна т, то удельные объемы насыщенного пара и жидкости при давлении р н.п будут равны
объем единицы массы вещества. Тогда, если масса вещества равна т, то удельные объемы насыщенного пара и жидкости при давлении р н.п будут равны
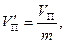
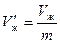 .
.
В состоянии, при котором масса жидкой фазы равна т ж, а масса пара равна т п, на долю жидкости будет приходиться объем 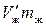 , а на долю насыщенного пара — объем
, а на долю насыщенного пара — объем 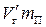 . В сумме оба эти объема должны быть равны объему V
. В сумме оба эти объема должны быть равны объему V
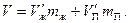
Подставив выражения для удельных объемов и заменив массу m = m ж + m п, получим:
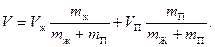
Тогда 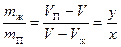 - отношение масс жидкости и насыщенного пара в двухфазном состоянии равно отношению отрезков, на которые делит горизонтальный участок изотермы точка, изображающая состояние.
- отношение масс жидкости и насыщенного пара в двухфазном состоянии равно отношению отрезков, на которые делит горизонтальный участок изотермы точка, изображающая состояние.
Итак, на диаграмме р, V состояниям равновесия между жидкостью и ее насыщенным паром соответствует горизонтальный участок изотермы. Концы этого участка отвечают объемам V 1 и V 2, занимаемым веществом в первой и второй фазах. Этими фазами могут быть жидкость и насыщенный пар, либо жидкость и кристаллы, либо две кристаллические модификации одного и того же вещества. Во всех случаях справедливо соотношение
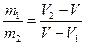
(m 1 и m 2 — массы вещества в первой и второй фазах).
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 776; Нарушение авторских прав?; Мы поможем в написании вашей работы!