
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Критическое состояние. Критическая изотерма
|
|
|
|
На рис. 7.4 приведены изотермы для нескольких значений температуры. Из рисунка видно, что с повышением температуры горизонтальный участок изотермы сокращается, стягиваясь в точку при температуре Т кр, называемой критической. Соответственно уменьшается различие в удельных объемах, а, следовательно, и в плотностях жидкости и насыщенного пара. При критической температуре это различие полностью исчезает. Одновременно исчезает всякое различие между жидкостью и паром. Температурный ход плотности жидкости и насыщенного пара показан на рис.7.5.
Точка К, являющаяся пределом, к которому приближаются горизонтальные отрезки изотерм при стремлении температуры к критическому значению Т кр, именуется критической точкой (рис.7.5). Состояние, изображаемое точкой К, называется критическим состоянием вещества. Объем V кр, давление р кр и температура Т кр, отвечающие критическому состоянию, называются критическими величинами. Для критической изотермы точка К служит точкой перегиба. Касательная к изотерме в точке К расположена параллельно оси V.
Из рис. 7.4 следует, что давление насыщенного пара растет с температурой, достигая при критической температуре значения р кр. При температурах выше критической понятие насыщенного пара теряет смысл. Поэтому кривая зависимости давления насыщенного пара от температуры заканчивается в критической точке.
 Если провести линию через крайние точки горизонтальных участков изотерм (рис.7.6), получается колоколообразная кривая, ограничивающая область двухфазных состояний вещества. При температурах выше критической вещество при любом давлении оказывается однородным. При таких температурах никаким сжатием не может быть осуществлено ожижение вещества.
Если провести линию через крайние точки горизонтальных участков изотерм (рис.7.6), получается колоколообразная кривая, ограничивающая область двухфазных состояний вещества. При температурах выше критической вещество при любом давлении оказывается однородным. При таких температурах никаким сжатием не может быть осуществлено ожижение вещества.
Понятие критической температуры впервые было введено Д. И. Менделеевым в 1860 г. Менделеев назвал ее температурой абсолютного кипения жидкости и рассматривал как ту температуру, при которой исчезают силы сцепления между молекулами, и жидкость превращается в пар независимо от давления и занимаемого ею объема.
 Колоколообразная кривая и участок критической изотермы, лежащий слева от точки К, делят диаграмму (р, V) на три области
Колоколообразная кривая и участок критической изотермы, лежащий слева от точки К, делят диаграмму (р, V) на три области (рис.7.6). Наклонной штриховкой помечена область однородных жидких состояний вещества. Под колоколообразной кривой располагается область двухфазных состояний, и наконец, область, лежащая справа от колоколообразной кривой и верхней ветви критической изотермы, представляет собой область однородных газообразных состояний вещества. Часть, лежащая под правой ветвью критической изотермы, - это областью пара. Любое состояние в этой области отличается от остальных газообразных состояний тем, что при изотермическом сжатии вещество, первоначально находившееся в таком состоянии, претерпевает процесс ожижения. Вещество, находящееся в одном из состояний при температуре выше критической, не может быть ожижено никаким сжатием.
(рис.7.6). Наклонной штриховкой помечена область однородных жидких состояний вещества. Под колоколообразной кривой располагается область двухфазных состояний, и наконец, область, лежащая справа от колоколообразной кривой и верхней ветви критической изотермы, представляет собой область однородных газообразных состояний вещества. Часть, лежащая под правой ветвью критической изотермы, - это областью пара. Любое состояние в этой области отличается от остальных газообразных состояний тем, что при изотермическом сжатии вещество, первоначально находившееся в таком состоянии, претерпевает процесс ожижения. Вещество, находящееся в одном из состояний при температуре выше критической, не может быть ожижено никаким сжатием.
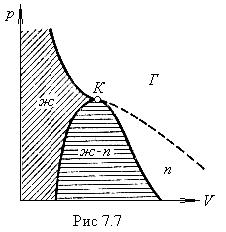
Выбрав процесс перехода так, чтобы он не пересекал двухфазную область (рис. 7.7), можно осуществить переход из жидкого состояния в газообразное (или обратно) без расслаивания вещества на две фазы. В этом случае в процессе перехода вещество будет все время оставаться однородным.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1240; Нарушение авторских прав?; Мы поможем в написании вашей работы!