
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пересыщенный пар и перегретая жидкость
|
|
|
|
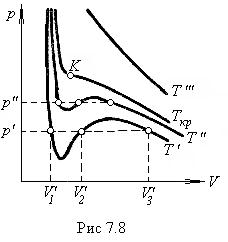
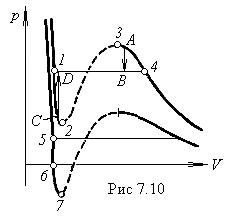
 На рис. 7.8 изображены изотермы Ван-дер-Ваальса, т.е кривые, описываемые уравнением Ван-дер-Ваальса, для нескольких температур. Характерным для этих изотерм является то, что при температурах, не превышающих значение Т кр, у кривых имеется S-образный завиток, в области которого заданному значению давления соответствуют три различных значения объема. У реальных изотерм (рис.7.9) такого завитка нет, вместо него у них имеется прямолинейный горизонтальный участок. На рис. 7.10 наложены одна на другую реальная изотерма и изотерма Ван-дер-Ваальса. Оказывается, что уравнение Ван-дер-Ваальса довольно хорошо описывает ход изотермы при объемах, больших V г. При объемах, меньших V ж, ход реальной изотермы также примерно следует уравнению Ван-дер-Ваальса. Таким образом, это уравнение охватывает не только газообразное, но и жидкое состояние вещества.
На рис. 7.8 изображены изотермы Ван-дер-Ваальса, т.е кривые, описываемые уравнением Ван-дер-Ваальса, для нескольких температур. Характерным для этих изотерм является то, что при температурах, не превышающих значение Т кр, у кривых имеется S-образный завиток, в области которого заданному значению давления соответствуют три различных значения объема. У реальных изотерм (рис.7.9) такого завитка нет, вместо него у них имеется прямолинейный горизонтальный участок. На рис. 7.10 наложены одна на другую реальная изотерма и изотерма Ван-дер-Ваальса. Оказывается, что уравнение Ван-дер-Ваальса довольно хорошо описывает ход изотермы при объемах, больших V г. При объемах, меньших V ж, ход реальной изотермы также примерно следует уравнению Ван-дер-Ваальса. Таким образом, это уравнение охватывает не только газообразное, но и жидкое состояние вещества.
|

|

|
|
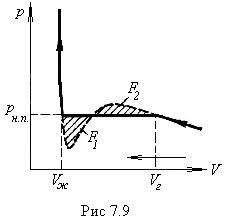
 Из сопоставления изотермы Ван-дер-Ваальса с реальной изотермой вытекает, что эти изотермы примерно совпадают на участках, отвечающих однофазным состояниям вещества, но ведут себя совершенно различным образом в области расслоения на две фазы. Вместо S -образного завитка на изотерме Ван-дер-Ваальса реальная изотерма имеет в этой области прямолинейный горизонтальный участок, который располагается так, что охватываемые завитком площади F 1 и F 2 (рис.7. 9) одинаковы.
Из сопоставления изотермы Ван-дер-Ваальса с реальной изотермой вытекает, что эти изотермы примерно совпадают на участках, отвечающих однофазным состояниям вещества, но ведут себя совершенно различным образом в области расслоения на две фазы. Вместо S -образного завитка на изотерме Ван-дер-Ваальса реальная изотерма имеет в этой области прямолинейный горизонтальный участок, который располагается так, что охватываемые завитком площади F 1 и F 2 (рис.7. 9) одинаковы.
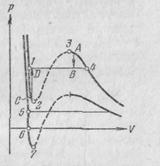
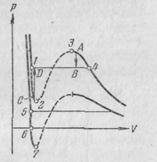
Расслоение на две фазы объясняется неустойчивостью однородных состояний, отвечающих завитку 1—2—3—4 (рис.7.10).Неустойчивость состояний на участке 2 — 3 становится очевидной, если учесть, что на этом участке производная dp / dV положительна. Следовательно, вещество, способное пройти последовательность
состояний 2—3, обладало бы совершенно противоестественными свойствами: увеличение объема газа сопровождалось бы не уменьшением, а ростом давления.
На участках 1—2 и 3—4 dp / dV отрицательно, так что, казалось бы, эти участки могли бы реализоваться. Действительно, при известных условиях состояния, соответствующие этим участкам, могут осуществляться. Правда, они не вполне устойчивы: достаточно, например, в состоянии А попадания в пар пылинки, чтобы все вещество распалось на две фазы и перешло в состояние В (переход А → В на рис. 7.10). Подобные не вполне устойчивые состояния называются метастабильными. Вещество в состояниях 1—2 называется перегретой жидкостью, вещество в состояниях 3—4 называется пересыщенным паром.
При достаточно низких температурах нижняя часть завитка изотермы Ван-дер-Ваальса пересекает ось V и переходит в область отрицательных давлений (нижняя изотерма на рис.7.10). Вещество под отрицательным давлением, очевидно, находится
в состоянии не сжатия, а растяжения. Такие состояния также могут быть при известных условиях реализованы. Таким образом, участок 5—6 на нижней изотерме соответствует перегретой, а участок 6—7 — растянутой жидкости.
Рассмотрим условия, при которых могут быть осуществлены метастабильные состояния. Начнем с пересыщенного пара. Если пар совершенно не содержит посторонних включений, конденсация его в жидкость начаться не может. Для образования капельки необходимо, чтобы большое количество молекул одновременно сблизилось на расстояния того же порядка, что и расстояния между молекулами в жидкости, а это совершенно невероятно. Для возникновения конденсации необходимо наличие так называемых центров конденсации, которые улавливают подлетающие к ним молекулы и переводят их в конденсированную фазу. Центрами конденсации могут служить пылинки, капельки жидкости и, в особенности, заряженные частицы (ионы.).
Таким образом, если пар тщательно очистить от посторонних включений и ионов, то он может находиться при давлении, превышающем давление насыщенных паров р н.п при данной температуре.
Такое состояние будет метастабильным: достаточно возникнуть хотя бы одному центру конденсации, как состояние пересыщенного пара будет нарушено и вещество перейдет в двухфазное состояние.
Практически пересыщенный пар можно получить, подвергнув непересыщенный пар резкому расширению. Быстрое расширение происходит без теплообмена с внешней средой и сопровождается охлаждением пара. Точка, изображающая состояние пара, перемещается при этом по адиабате. Адиабата идет круче, чем 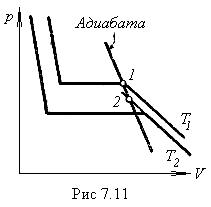 изотерма, вследствие чего пар из стабильного состояния 1, соответствующего температуре Т 1, (рис. 7.11), может перейти в метастабильное состояние 2, соответствующее более низкой температуре Т 2.
изотерма, вследствие чего пар из стабильного состояния 1, соответствующего температуре Т 1, (рис. 7.11), может перейти в метастабильное состояние 2, соответствующее более низкой температуре Т 2.
 Рассмотрим условия получения перегретой жидкости. Процесс бурного парообразования (т. е. кипения) может, как и процесс конденсации, происходить на инородных включениях, например на песчинках или пузырьках газа, растворенного в жидкости. Если жидкость тщательно очистить от твердых включений и растворенных в ней газов, то путем нагревания ее можно перевести в состояние с давлением, меньшим р н.п при данной температуре, без того, чтобы жидкость вскипала. Это и будет состояние перегретой жидкости.
Рассмотрим условия получения перегретой жидкости. Процесс бурного парообразования (т. е. кипения) может, как и процесс конденсации, происходить на инородных включениях, например на песчинках или пузырьках газа, растворенного в жидкости. Если жидкость тщательно очистить от твердых включений и растворенных в ней газов, то путем нагревания ее можно перевести в состояние с давлением, меньшим р н.п при данной температуре, без того, чтобы жидкость вскипала. Это и будет состояние перегретой жидкости.
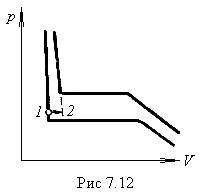
Переход жидкости из обычного состояния в перегретое показан на рис. 7.12 (переход 1—2). Состояние перегретой жидкости является метастабильным. Достаточно бросить в перегретую жидкость песчинку для того, чтобы жидкость вскипела и вещество перешло в стабильное двухфазное состояние (переход С — D на рис. 7.10).
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1154; Нарушение авторских прав?; Мы поможем в написании вашей работы!