
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительных реакций
|
|
|
|
Методы составления уравнений
При составлении уравнений ОВР, для удобства, в исходных веществах вначале ставят записывать восстановитель, затем окислитель и среду (если это необходимо); в продуктах реакции – продукты окисления, затем восстановления и другие вещества. Применяются два метода составления ОВР: электронного баланса и полуреакций (ионно-электронный метод).
Метод электронного баланса. Рассмотрим следующую реакцию
Na2SO3 + KMnO4+ H2SO4 = Na2SO4 + K2SO4 + MnSO4 + H2O.
Определяют окислительные числа элементов до и после реакции
+1 +4 –2 +1+7 -2 +1+6-2 +1+6-2 +1+6-2 +2+6-2 +1-2
Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + K2SO4 + MnSO4+H2O
Находят окислитель и восстановитель. Ион серы (S+4) в Na2SO3 повышает свою степень окисления, то есть теряет электроны, является восстановителем и в процессе реакции окисляется. Ион марганца (Mn+7) в KMnO4 понижает свою степень окисления, то есть присоединяет электроны, является окислителем и в процессе реакции восстанавливается, следовательно, в этой реакции Na2SO3 – восстановитель, KMnO4 – окислитель.
Записывают в левой части начальное состояние серы и марганца, а в правой – конечное и определяют количество потерянных S+4 и принятых Mn+7 электронов
S4+ – 2e = S6+
Mn7+ + 5e = Mn2+
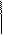
 Составляют электронный баланс, то есть общее число электронов, отданных восстановителем, должно быть равно общему числу электронов принятых окислителем. Определяют общее количество отданных и принятых электронов (общее наименьшее кратное). Оно равно 10. Следовательно, 10 электронов теряют 5 ионов серы и присоединяют 2 иона марганца
Составляют электронный баланс, то есть общее число электронов, отданных восстановителем, должно быть равно общему числу электронов принятых окислителем. Определяют общее количество отданных и принятых электронов (общее наименьшее кратное). Оно равно 10. Следовательно, 10 электронов теряют 5 ионов серы и присоединяют 2 иона марганца
S4+ – 2e = S6+ 2 5
Mn7+ + 5e = Mn2+ 5 2
Переносят эти коэффициенты в уравнение реакции
5Na2SO3 + 2KMnO4 + H2SO4 = 5Na2SO4 + K2SO4 + 2MnSO4 + H2O
Определяют число молекул H2SO4, участвующих в реакции образования двух молекул MnSO4 и молекулы K2SO4, и оно равно трем
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + K2SO4 + 2MnSO4 + H2O
По количеству атомов водорода в серной кислоте определяют число молекул воды
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + K2SO4 + 2MnSO4 +3H2O
Правильность расстановки коэффициентов проверяют по числу атомов кислорода в левой и правой частях уравнения.
Метод полуреакций. Как показывает название, этот метод предусматривает раздельное составление ионных реакций для процесса окисления и процесса восстановления с последующим суммированием их в общее ионное уравнение. При этом сильные электролиты записывают в виде ионов, а слабые электролиты записывают в виде молекул.
В ионную схему включают те частицы, которые подвергаются изменению, то есть проявляют восстановительные или окислительные свойства, а также частицы, характеризующие среду: кислую – ион H+ , щелочную – OH- и нейтральную – H2O. Этот метод удобно использовать в том случае, когда реакция протекает в растворе или расплаве. Поэтому в электронно-ионном методе записывают реально существующие ионы
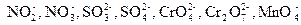 .
.
Пример 1. Составить уравнение реакции взаимодействия KNO2 с K2Cr2O7 в кислой среде, используя метод полуреакций. Определяют окислитель и восстановитель. Окислителем в этой реакции является ион 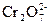 . В кислой среде он принимает 6 электронов и образует 2 иона Сr3+, а освободившийся кислород вместе с ионом H+ среды образует молекулы воды
. В кислой среде он принимает 6 электронов и образует 2 иона Сr3+, а освободившийся кислород вместе с ионом H+ среды образует молекулы воды
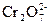 + 14H+ + 6e = 2Cr3+ + 7H2O.
+ 14H+ + 6e = 2Cr3+ + 7H2O.
Это уравнение первой полуреакции – восстановление окислителя. Восстановителем является ион 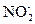 . Он отдает два электрона и окисляется до иона
. Он отдает два электрона и окисляется до иона 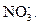 Получающийся в ходе реакции ион
Получающийся в ходе реакции ион 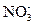 содержит больше кислорода, чем ион
содержит больше кислорода, чем ион 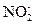 . Недостающее количество кислорода пополняется за счёт молекулы воды, при этом освобождается 2Н+ -иона
. Недостающее количество кислорода пополняется за счёт молекулы воды, при этом освобождается 2Н+ -иона
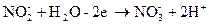 .
.
Общее число электронов, отдаваемых восстановителем и присоединяемых окислителем, должно быть равным. В нашем примере оно равно 6. Отсюда, записав уравнения обеих полуреакций, находят коэффициенты для окислителя и восстановителя
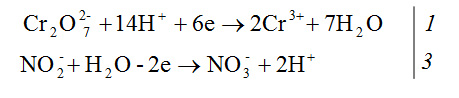
Суммируют электронно-ионные уравнения (предварительно умноженные на коэффициенты)
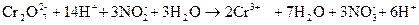
Сокращают подобные члены и составляют сокращенное ионное уравнение
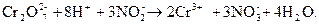
Поэтому ионному уравнению составляют молекулярное уравнение, для чего каждому аниону приписывают соответствующий катион, а каждому катиону – соответствующий анион. И, как правило, сначала записывают формулы молекул восстановителя, затем – окислителя и среды
3KNO2 + K2Cr2O7 + 4H2SO4= 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O.
При составлении уравнений методом полуреакций следует учитывать следующие факторы:
а) записывать в ионном виде восстановитель, окислитель и продукты их взаимодействия, а затем уже приступать к составлению уравнений полуреакций. Сильные электролиты записывают в виде ионов, а слабые электролиты, газы и вещества, выпадающие в виде осадков, в виде молекул. Продукты реакции (взаимодействия восстановителя и окислителя) устанавливаются опытным путём на основании известных свойств элементов;
б) если исходное вещество содержит больше кислорода, чем продукт реакции, то освобождающийся кислород в форме О2- связывается в кислых растворах ионами Н+ в воду, а в нейтральных растворах – в гидроксид-ионы
О2- + 2Н+ = Н2О или О2- + Н2О = 2ОН-;
в) если же исходное вещество содержит меньше атомов кислорода, чем продукты реакций, то недостаток их восполняется в кислых и нейтральных растворах за счёт молекул воды
Н2О = О2- + 2Н+,
а в щелочных – за счёт гидроксид-ионов
2ОН– = О2- + Н2О;
г) суммарное число и знак электрических зарядов слева и справа от знака равенства должны быть равны.
Достоинство метода полуреакций по сравнению с методом электронного баланса в том, что в нем используются реально существующие, а не гипотетические ионы. В самом деле, в растворе нет ионов Мn+7, Cr+6, S+6, а есть ионы 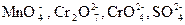 .
.
При этом не нужно определять степени окисления атомов, а также видна роль среды как активного участника процесса. Наконец, при использовании метода полуреакций не нужно знать все образующиеся вещества: они определяются в уравнении реакции при его выводе.
Следует отдавать предпочтение методу полуреакций и применять его при составлении уравнений всех окислительно-восстановительных реакций, которые протекают в водных растворах и расплавах.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 730; Нарушение авторских прав?; Мы поможем в написании вашей работы!