
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термическое уравнение состояния рабочего тела
|
|
|
|
Хаотическое движение молекул газа имеет тот результат, что они стремятся к равномерному распределению по всему предоставленному им объему, а взаимный обмен энергией обуславливает равномерное распределение между ними всей внутренней энергии газа. Таким образом, наиболее естественным является такое состояние газа, при котором удельный объем, давление и температура, а вместе с ними и все остальные параметры, имеют одинаковое значение во всех точках объема, занимаемого газом. Такое термодинамическое состояние газа называется равновесным. Внешние воздействия (например, односторонний нагрев или перемещение поршня в цилиндре, заполненном газом) нарушают равновесие, и параметры газа перестают быть одинаковыми во всех точках, но после того, как внешнее возмущение прекратится, газ вновь приходит самопроизвольно к состоянию равновесия.
Отсюда видно, что всякий реальный процесс перехода газа из одного состояния в другое неизбежно связан с нарушением термодинамического равновесия, и каждое из промежуточных состояний его является неравновесным.
Однако в технической термодинамике реальные условия идеализируются. В ней рассматриваются только равновесные состояния газа, а всякий процесс перехода его из одного состояния в другое рассматривается как непрерывная последовательность переходов газа от одного равновесного состояния к другому, бесконечно близкому к нему равновесному состоянию. Это дает возможность характеризовать каждое из промежуточных состояний газа конкретными значениями рассмотренных выше термических параметров p, 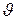 и Т.
и Т.
Значение каждого из термических параметров определяется одними и теми же факторами, а именно – скоростью движения молекул и средним расстоянием между ними, которые для каждого конкретного состояния газа имеют вполне определенную величину. Поэтому они связаны между собой однозначной зависимостью, которая аналитически выражается в общем виде уравнением
 ,
,
которое называется термическим уравнением состояния.
Выражая каждый из термических параметров как явную функцию двух остальных, данное уравнение можно предоставить в одной из следующих формул
 .
.
Эти уравнения показывают, что из трех параметров, определяющих состояние газа, независимыми являются только два, а третий является их функцией. Следовательно, термодинамическое состояние газа можно считать известным, если заданы значения двух его параметров, поскольку третий параметр может быть вычислен из уравнения состояния.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 588; Нарушение авторских прав?; Мы поможем в написании вашей работы!