
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Внутренняя энергия и энтальпия рабочего тела как функция состояния
|
|
|
|
Внутренняя энергия U является экстенсивным свойством газа, т.е. зависит от его массы (в противоположность свойствам, не зависящим от массы и называемым интенсивными). Поэтому для большей определенности внутреннюю энергию газа обычно относят к единице массы (1кг). Такая удельная внутренняя энергия обозначается буквой u. Таким образом, если масса рассматриваемого газа равна М кг, то
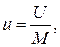 Дж/кг. (1.5)
Дж/кг. (1.5)
Из самого определения внутренней энергии вытекает, что каждому состоянию газа соответствует одно и только одно значение внутренней энергии. Это означает, что внутренняя энергия представляет собой однозначную функцию состояния или, иначе, однозначную функцию любых двух независимых параметров, определяющих это состояние.
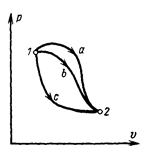
Поэтому изменение внутренней энергии в каком – либо процессе не зависти от характера процесса, а однозначно определяется заданными начальным и конечным состояниями газа. Так, в процессах а,b и с (рис 1.1.), в которых начальные и конечные состояния газа одинаковы, одинаковыми будут и изменения внутренней энергии 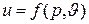 :
:
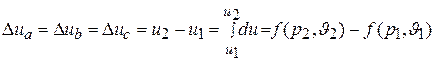 .
.
Математически это означает, что дифференциал du является полным дифференциалом функции 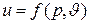 и может быть представлен равенством
и может быть представлен равенством

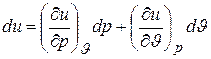 . (1.6)
. (1.6)
Очевидно, что если процесс замкнут, т.е. если после завершения его газ возвращается в исходное состояние (такие процессы в термодинамике называются круговыми процессами или циклами), то изменение внутренней энергии в нем будет равно нулю:
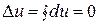 .
.
Как нетрудно видеть, аналогичными свойствами обладают все рассмотренные выше параметры: p, 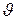 и Т. Следовательно, и внутренняя энергия может служить параметром состояния газа. Как и все другие параметры состояния, измеряемые в тепловых единицах (Дж), она относится к калорическим параметрам, а уравнение состояния, в состав которого входит внутренняя энергия (или какой – либо другой калорический параметр), например уравнение
и Т. Следовательно, и внутренняя энергия может служить параметром состояния газа. Как и все другие параметры состояния, измеряемые в тепловых единицах (Дж), она относится к калорическим параметрам, а уравнение состояния, в состав которого входит внутренняя энергия (или какой – либо другой калорический параметр), например уравнение
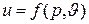
называется калорическим уравнением состояния.
Наряду с внутренней энергией в дальнейшем изложении основ технической термодинамики важную роль играет величина
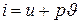 , кДж/кг, (1.7)
, кДж/кг, (1.7)
называемая энтальпией газа. Будучи составленной из функций состояния, энтальпия сама является функцией состояния и играет роль одного из калорических параметров состояния. Очевидно, что все свойства функции состояния имеет и энтальпия. Например, если задана зависимость 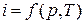 ,то
,то
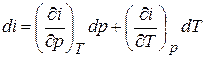 , (1.8)
, (1.8)
т.е. дифференциал энтальпии является полным дифференциалом.
Равным образом, для цикла
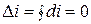 ,
,
а для незамкнутого процесса 1–2
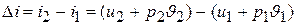 ,
,
независимо от пути, по которому протекает процесс.
Энтальпия представляет собой в общем случае чисто математическую величину и приобретает конкретный физический смысл лишь применительно к процессам, протекающим в газовом потоке, которые будут рассматриваться ниже.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 778; Нарушение авторских прав?; Мы поможем в написании вашей работы!