
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Комплексные соединения
|
|
|
|
Лекция 7
В качестве реагентов аналитических реакций широко распространены комплексные соединения, например при анализе катиона 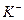 используется гексанитрокобальтат (III) натрия
используется гексанитрокобальтат (III) натрия 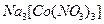 . Процесс комплексообразования также может происходить в ходе качественной реакции, например, алюминий даёт комплексные соединения с ализарином и алюминоном.
. Процесс комплексообразования также может происходить в ходе качественной реакции, например, алюминий даёт комплексные соединения с ализарином и алюминоном.
Комплексными или координационными соединениями называются сложные соединения, у которых имеются связи, образованные по донорно-акцепторному механизму в результате насыщения химическими связями некоторых атомов, молекул или ионов, за счет вакантных (акцепторы) или заполненных (доноры) орбиталей. Согласно координационной теории А. Вернера комплексные соединения состоят из двух сфер: внешней и внутренней. У 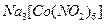 ионом внешней сферы являются ионы
ионом внешней сферы являются ионы 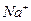 . Внутренняя сфера, называемая также комплексом, включает центральный ион, вокруг которого координируются (геометрически правильно располагаются в пространстве) отрицательно заряженные ионы или нейтральные молекулы. Внутреннюю сферу при написании формулы заключают в квадратные скобки -
. Внутренняя сфера, называемая также комплексом, включает центральный ион, вокруг которого координируются (геометрически правильно располагаются в пространстве) отрицательно заряженные ионы или нейтральные молекулы. Внутреннюю сферу при написании формулы заключают в квадратные скобки - 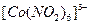 . Центральный ион называется комплексообразователем, а координируемые им ионы или молекулы – лигандами.
. Центральный ион называется комплексообразователем, а координируемые им ионы или молекулы – лигандами.
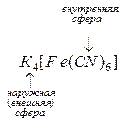
|
|




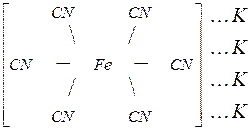
Комплексный ион является как катионом, так и анионом.
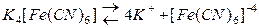
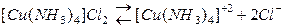
Координационное число (К. Ч.) является для комплексных соединений важнейшей характеристикой и определяет его состав и структуру.
Большой вклад в теорию комплексных соединений внесли Вернер (1891г) и Чугаев (1897г).
Лиганды в зависимости от координационного числа могут быть в количестве от 2х до 8 (10) (координационное число 4 и 6 у 95% комплексных соединений).
| Металлы | Координационное число | Число атомов комплексообразователя радиус в А˚ |
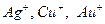
| 0,2 | |
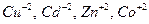
| 0,2-0,4 | |
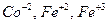
| 0,4-0,6 | |
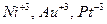
| ||
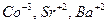
| 0,8 |
Комплексообразователь связан с лигандами σ-связью. Чаще всего бывает атомы или ионы металлов со свободной орбиталью (акцепторы). Но у 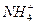 и
и 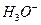 акцепторами электронных пар являются ионы водорода.
акцепторами электронных пар являются ионы водорода.
При увеличении степени окисления можно говорить о росте координационного числа. Кроме того повышению координационного способствует большой радиус комплексообразователя.
(Бор 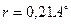 к.ч.=4,
к.ч.=4,
Al 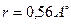 к.ч. = 6.)
к.ч. = 6.)
Хотя способность к комплексообразованию – общее свойство химических элементов, но наиболее прочные комплексы образуют металлы, имеющие вакантные 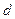 - орбитали. В блоках периодической системы комплексообразующая способность уменьшается примерно в следующем порядке:
- орбитали. В блоках периодической системы комплексообразующая способность уменьшается примерно в следующем порядке: 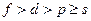 . Например, для жизнедеятельности человека особенно важны комплексные соединения таких
. Например, для жизнедеятельности человека особенно важны комплексные соединения таких 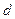 - элементов, как
- элементов, как 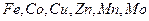 . Амфотерные
. Амфотерные 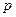 - элементы
- элементы 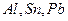 также образуют различные комплексы, биогенные
также образуют различные комплексы, биогенные 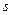 - элементы могут образовывать непрочные комплексные соединения только с лигандами определённой структуры. В данном примере центральным ионом является
- элементы могут образовывать непрочные комплексные соединения только с лигандами определённой структуры. В данном примере центральным ионом является 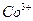 . Число лигандов, координируемых комплексообразователем, называют координационным числом. В данном случае оно равно 6.
. Число лигандов, координируемых комплексообразователем, называют координационным числом. В данном случае оно равно 6.
В зависимости от заряда различают анионные комплексы, например, 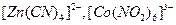 ; катионные комплексы, например,
; катионные комплексы, например, 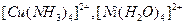 ; нейтральные комплексы -
; нейтральные комплексы - 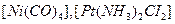 . Нейтральные комплексы не имеют ионов внешней сферы. Заряд комплекса численно равен сумме заряда центрального иона и зарядов лигандов. Например, заряд
. Нейтральные комплексы не имеют ионов внешней сферы. Заряд комплекса численно равен сумме заряда центрального иона и зарядов лигандов. Например, заряд 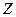 комплекса
комплекса 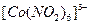 равен
равен 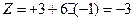 .
.
К числу лигандов относятся простые анионы, такие как 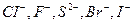 , сложные анионы, например
, сложные анионы, например 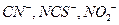 , молекулы, например
, молекулы, например 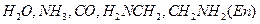 . Ионы или отдельные атомы ионов или молекул лигандов имеют неподелённые пары электронов. В зависимости от того, какое число вакантных орбиталей у комплексообразователя занимают лиганды, они подразделяются на монодентантные (одна орбиталь), например
. Ионы или отдельные атомы ионов или молекул лигандов имеют неподелённые пары электронов. В зависимости от того, какое число вакантных орбиталей у комплексообразователя занимают лиганды, они подразделяются на монодентантные (одна орбиталь), например 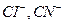 ; бидентантные (две орбитали), например
; бидентантные (две орбитали), например 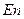 ; полидентатные, например этилендиаминотетрауксусная кислота.
; полидентатные, например этилендиаминотетрауксусная кислота.
К комплексным соединениям, содержащим молекулярные монодентантные лиганды, относятся:
· аквакомплексы, или гидраты, лигандами являются молекулы воды, например 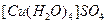 . В водных растворах таких соединений каждый ион гидратирован, при кристаллизации некоторые из веществ способны удерживать определённое число молекул, образуя кристаллогидраты;
. В водных растворах таких соединений каждый ион гидратирован, при кристаллизации некоторые из веществ способны удерживать определённое число молекул, образуя кристаллогидраты;
· аммикаты, содержащие в качестве лигандов молекулы аммиака, например 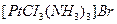 ;
;
· карбонилы, в которых лигандами служат молекулы оксида углерода, например 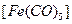 .
.
К комплексным соединениям, содержащим ионные лиганды, относятся ацидокомплексы, у которых в качестве лиганд выступают анионы какой-либо кислоты, например 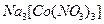 . К ацидокомплексам также относятся соединения, называемые двойными солями, например
. К ацидокомплексам также относятся соединения, называемые двойными солями, например 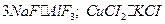 .
.
В аналитической химии (количественный анализ) широко распространены циклические комплексные соединения на основе аминополикарбоновых кислот, например этилендиаминотетрауксусная кислота и её соли (комплексоны).
Существую также многоядерные комплексные соединения, в которых два или несколько комплексообразователей соединены посредством лигандов. Например, в двухъядерном комплексном соединении 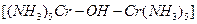 два иона
два иона 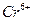 , являющихся комплексообразователями, связаны посредством группы
, являющихся комплексообразователями, связаны посредством группы 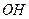 . Такая связующая группа называется мостиковой. В качестве мостиковых групп могут выступать все полидентатные лиганды (за исключением лигандов, образующих комплексоны), а также монодентатные лиганды, обладающие неподелёнными электронными парами:
. Такая связующая группа называется мостиковой. В качестве мостиковых групп могут выступать все полидентатные лиганды (за исключением лигандов, образующих комплексоны), а также монодентатные лиганды, обладающие неподелёнными электронными парами: 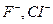 и др.
и др.
При составлении названия комплексного соединения первым упоминается анион в именительном падеже, затем катион в родительном, независимо от того, какой из этих ионов комплексный. В названии комплексного иона сначала перечисляются лиганды в алфавитном порядке с приставками, обозначающими их число. Если комплексный ион – анион, название комплексообразователя содержит суффикс –ат. После названия указывается степень окисления центрального иона. Например,
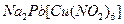 - гексанитрокупрат (II) натрия-свинца;
- гексанитрокупрат (II) натрия-свинца;
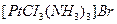 - бромид триамминтрихлорплатины (IV);
- бромид триамминтрихлорплатины (IV);
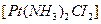 - диаммндихлорплатина (II).
- диаммндихлорплатина (II).
Комплексные соединения подвергаются ступенчатой диссоциации. По первой ступени происходит диссоциация на ионы внешней сферы и комплексный ион. Комплексные соединения являются сильными электролитами, и диссоциация по первой ступени протекает легко:
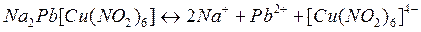
Диссоциации по второй ступени подвергается комплексный ион и она протекает по типу слабых электролитов
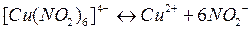
Применяя закон действия масс к этому процессу, получим константу нестойкости данного комплексного иона:
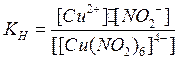
Чем больше константа нестойкости, тем легче проходит процесс диссоциации по второй ступени.
Пользуясь константой нестойкости можно определить концентрацию частиц в растворе, образующихся при распаде комплексного иона.
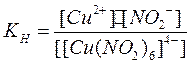
Чем больше константа нестойкости, тем легче проходит процесс диссоциации по второй ступени.
Пользуясь константой нестойкости, можно определить концентрацию частиц в растворе, образующихся при распаде комплексного иона.
Величина, обратная константе нестойкости, называется константой устойчивости 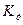 и по её значению с помощью уравнения изотермы химической реакции (VII.1) можно рассчитать стандартную энергию Гиббса образования комплекса:
и по её значению с помощью уравнения изотермы химической реакции (VII.1) можно рассчитать стандартную энергию Гиббса образования комплекса:
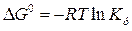
Эта величина является энергетической характеристикой реакции образования комплексных соединений. Её часто в справочниках и пособиях обозначают β, а логарифм константы устойчивости 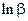 .
.
Устойчивость комплексных соединений зависит как от природы центрального атома, так и от природы связанных с ним лиганд, но следует отметить, что полидентантные лиганды связываются с ионами металла гораздо сильнее, чем монодентантные лиганды с теми же донорными атомами. Например, прочность хелатных этилендиаминовых комплексов 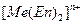 на 8-10 порядков выше, чем прочность комплексных ионов тех же металлов
на 8-10 порядков выше, чем прочность комплексных ионов тех же металлов 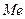 с аммиаком
с аммиаком 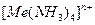 . Повышенная устойчивость хелатных комплексов объясняется дополнительной координацией за счёт взаимосвязанности донорных атомов.
. Повышенная устойчивость хелатных комплексов объясняется дополнительной координацией за счёт взаимосвязанности донорных атомов.
Процесс образования (и диссоциации) комплексного соединения в действительности протекает ступенчато. Например, реакция образования комплекса иона свинца с ионом йодида проходит через следующие промежуточные стадии, характеризующиеся соответствующими ступенчатыми константами устойчивости:
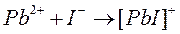
| 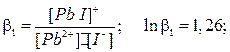
|
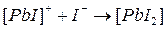
| 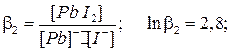
|
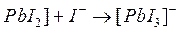
| 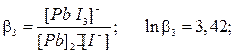
|
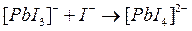
| 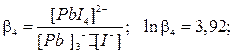
|
Ступенчатые константы устойчивости связаны с общей простым соотношением:
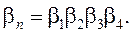
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 2159; Нарушение авторских прав?; Мы поможем в написании вашей работы!