
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изомерия комплексных соединений
|
|
|
|
Расположение лигандов в пространстве вокруг комплексообразователя, определяющее форму комплексной частицы, зависит от многих факторов:
1) направленность орбиталей комплексообразователя (образование σ-связей);
2) симметрия заполнения его d-орбиталей электронами;
3) размеры и взаимовлияние лигандов.
I Различают геометрическую изомерию:
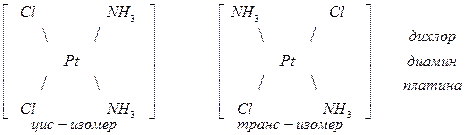
которая возможна для комплексов имеющих 2, 4, 6 и т.д. к.ч. При расположении одинаковых лигандов по одну сторону получается цис – изомер, по разные транс – изомер.
II Оптическая (или зеркальная) изомерия возможна для асимметричных комплексов, которые не имеют ни одной плоскости симметрии, делящей молекулу на две одинаковые (симметричные) части. Они (комплексы) способны вращать плоскость поляризации света: один влево (l – изомер), другой вправо (d – изомер).
III Сольватная изомерия: возникает при изменении распределения молекул растворителя между внутренней и внешней сферами комплекса. Для водных растворов этот ид изомерии называется гидратным.
При нагревании водного раствора 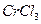 фиолетовая окраска изменяется на темно-зеленую, что объясняется вытеснением из внутренней сферы молекул
фиолетовая окраска изменяется на темно-зеленую, что объясняется вытеснением из внутренней сферы молекул 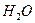 ионами
ионами 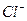 :
:
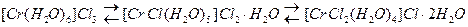
IV Ионизационная изомерия возникает при содержании во внутренней и внешней сферах неодинаковых ионных лигандов.
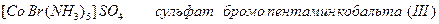
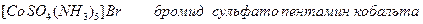 .
.
V Координационная изомерия возможна для соединений, состоящих из комплексных катионов и анионов, каждый из которых способен содержать любой из 2х комплексообразователей.
Например:
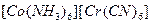 и
и 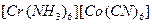
Существуют и другие, встречающиеся реже, виды изомерии комплексных соединений.
Теория кристаллического поля. ЭСКП. Электронные формулы и свойства. Октаэдрические, тетраэдрические комплексы. Объяснения магнитных и оптических свойств комплексных соединений.
По силе своего транс влияния лиганды располагаются в 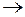 ряд. (т.е. влияние друг на друга внутри сферы).
ряд. (т.е. влияние друг на друга внутри сферы).
Слева направо активность ряда падает, каждый предыдущий более активен по сравнению с последующим.
Лиганды стоящие в начале ряда способны удалению лигандов стоящих справа.
а) 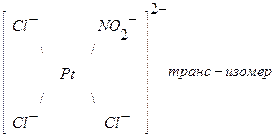
из 3х ионов – Cl внутренней сферы комплекса легче замещается тот ион, который находится в транс положении к сильному транс – активному NO2–.
б) 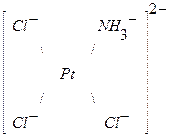
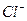 – стоящий в транс положении к менее транс – активному NH3 закреплен прочнее других ионов Cl– и потому менее активен.
– стоящий в транс положении к менее транс – активному NH3 закреплен прочнее других ионов Cl– и потому менее активен.
С точки зрения поляризационной теории комплексообразователь поляризует лиганды и создает в них индуцированный момент.
Если вокруг комплексообразователя симметрично располагаются лиганды одного и того же типа, то они находятся в симметричном поле, и все индуцированные моменты компенсируют друг друга.
При замещении одного из лигандов на более транс – активные симметрии поле нарушается и вокруг комплексообразователя создается нескомпенсированный момент.
Природа химической связи в комплексных соединениях
Существуют 3 типа связи, которые объясняют природу химической связи в комплексных соединениях:
1. Метод В.С. (валентных связей).
2. Теория кристал. поля.
3. Метод МО (молекулярных орбиталей).
1. В основе метода валентных связей лежат положения:
1. связь между комплексообразователем и лигандами донорно – акцепторного механизма.
Лиганды представляют свободные электронные пары, а комплексообразователь свободные орбитали. Мерой прочности такой связи служит степень перекрывания  -орбиталей.
-орбиталей.
2. Орбитали центрального поля участвуют в образовании связи подвергающейся гибридизации, тип которой определяется природой и структурой лиганда.
Магнитные свойства определяются наличием неспаренных валентных электронов.
Если электроны спарены, то комплекс диамагнитен (не обладает магнитными свойствами)
Механизм образования связи и тип её гибридизации зависит также от природы комплексообразователя.
Реакционная способность комплексных соединений во многом зависит от скорости обмена лигандов на ионы или молекулы. Условиями благоприятными для обмена лигандов является:
1) внешняя гибридизация
2) положение у комплексообразователя свободных внутренних d-орбиталей: в случае внешней гибридизации связь лигандов с комплексообразователем значительно слабее, чем при внутренней гибридизации, поэтому их обмен осуществляется с меньшими энергетическими затратами. Данный комплекс более активен (реакционно способен).
Теория кристаллического поля
Она рассматривает воздействия лигандов на d-орбитали комплексообразователя. Лиганды располагаются относительно (+) заряженного иона (–) концами своего диполя. В результате между d-электронами (центрального) и лигандами образуется сила отталкивания, что приводит к увеличению энергии d-электрона. Однако она неоднородна и зависит от расстояния и природы лиганда.
Рассмотрим несколько случаев:
1) если d -  располагаются близко к лигандам, то энергия их увеличивается.
располагаются близко к лигандам, то энергия их увеличивается.
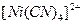
2) если d - 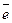 расположены дальше от лигандов, то энергия их уменьшается.
расположены дальше от лигандов, то энергия их уменьшается.
Т.е. под действием лигандов происходит расщепление энергетического уровня d-орбиталей.
Величина е – расщепления зависит от природы лиганда и конфигурации комплекса.
Для перевода 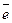 с одной орбитали на другую необходимо затратить энергию (Р).
с одной орбитали на другую необходимо затратить энергию (Р).

При этом возможны 2 случая:
1) Если 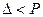 , то электроны центрального поля в комплексе занимают те же орбитали, что и в свободном ионе. В этом случае ион Ме находится в состоянии с высоким значением S.
, то электроны центрального поля в комплексе занимают те же орбитали, что и в свободном ионе. В этом случае ион Ме находится в состоянии с высоким значением S.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1600; Нарушение авторских прав?; Мы поможем в написании вашей работы!