
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение состояния идеального газа. Опытные газовые законы
|
|
|
|
В МКТ используют идеализированную модель идеального газа.
Идеальный газ - это газ, молекулы которого можно рассматривать как материальные точки, а их взаимодействие носит характер абсолютно упругого удара. (при низком р и высокой Т реальные газы приближаются к идеальным).
Состояние некоторой массы газа определяется тремя термодинамическими параметрами: р,V,T.
Давление газа представляет собой результат ударов молекул газа о стенки сосуда, в котором газ находится.
[ р ]=1Па, [ V ]= 1м3.
В соответствии с решением XI Генеральной конференции по мерам и весам (1960 г.) применяют две температурные шкалы - термодинамическую (Кельвина) и Международную практическую (Цельсия).
За 0°С принята температура замерзания воды при р =1 атм. За 0 К принята температура, при которой должно прекратиться хаотическое движение молекул. Анализ различных процессов показывает, что 0 К недостижим, хотя приближение к нему сколь угодно близко возможно.
Градус Кельвина равен градусу Цельсия.
Т= t°С+ 273, DT=Dt°.
Между параметрами газа существует определенная связь, называемая уравнением состояния. Уравнение, связывающее параметры состояния идеального газа, называется уравнением состояния идеального газа или уравнением Клапейрона:
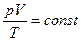 . (1)
. (1)
Для данной массы идеального газа отношение произведения давления на объем к абсолютной температуре есть величина постоянная.
Определим значение константы 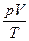 для определенного количества идеального газа, а именно для одного моля.
для определенного количества идеального газа, а именно для одного моля.
Согласно закону Авогадро 1 моль любого газа при нормальных условиях (Т0 =273 К, р0 =105 Па) имеет VМ = 22,4×10-3 м3.
Для одного моля
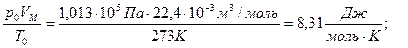
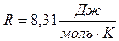 - молярная газовая постоянная.
- молярная газовая постоянная.
Для произвольной массы газа
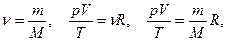
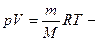 уравнение Менделеева-Клапейрона – уравнение состояния идеального газа произвольной массы.
уравнение Менделеева-Клапейрона – уравнение состояния идеального газа произвольной массы.
Уравнение (1) объединяет в себе три частных случая, три эмпирических закона для изопроцессов, т.е. процессов, при которых один из параметров остается постоянным.
1. Т = const – изотермический процесс,
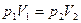 или
или 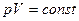 -
-
закон Бойля-Мариотта: 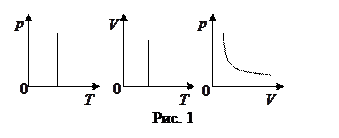 для данной массы идеального газа при Т = const произведение давления на объем есть величина постоянная.
для данной массы идеального газа при Т = const произведение давления на объем есть величина постоянная.
Графики зависимости между параметрами состояния газа при Т =const представлены на рис. 1.
2. 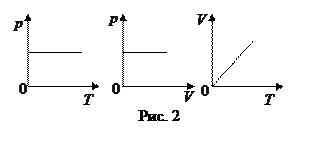 р = const – изобарный процесс,
р = const – изобарный процесс, 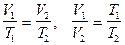 или
или 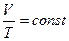
 -
-
закон Гей-Люссака: для данной массы идеального газа при р =const объем прямо пропорционален абсолютной температуре.
Графики зависимости между параметрами состояния газа при р =const представлены на рис. 2.
3. 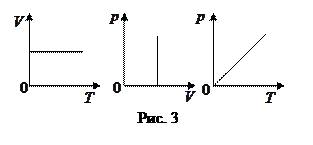 V=const – изохорный процес с,
V=const – изохорный процес с, 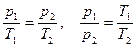 или
или 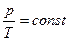 - закон Шарля: для данной массы идеального газа при V =const давление прямо пропорционально абсолютной температуре.
- закон Шарля: для данной массы идеального газа при V =const давление прямо пропорционально абсолютной температуре.
Графики зависимости между параметрами состояния газа при V =const представлены на рис. 3.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 638; Нарушение авторских прав?; Мы поможем в написании вашей работы!