
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кривые и диаграммы титрования
|
|
|
|
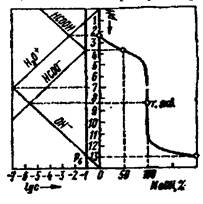
Ход реакции титрования может быть изображен графической моделью, называемой кривой титрования, отражающей зависимость между концентрацией компонентов и каким-либо свойством системы с титруемым веществом — титрантом. По мере добавления титранта в системе происходит изменение количественного соотношения исходных веществ и продуктов реакции и вследствие этого изменение свойства системы. В титриметрии строят логарифмические кривые в координатах «логарифм свойства - концентрация». По оси абсцисс откладывают либо объём, либо % добавленного титранта, либо степень оттитровывания[1]; по оси ординат — свойство системы
τ = СτVτ/C0V0
Практическое значение для анализа имеет область кривой титрования, называемая скачком титрования, в которой происходит резкое (скачкообразное) изменение свойства системы. Это связано с тем, что в области скачка происходит изменение концентрации реагирующих веществ на несколько порядков. Началом скачка титрования считают момент добавления 99,9% титранта (т. е. недотитровано 0,1% анализируемого вещества), концом скачка — добавление 100,1% (т. е. вещество перетитровано на 0,1%). При визуальном фиксировании точки конца реакции с помощью вводимых в систему индикаторов необходимо провести предварительный расчет области скачка титрования, чтобы правильно выбрать индикатор (интервал перехода окраски индикатора должен полностью или частично укладываться в пределы скачка титрования).
Величина скачка титрования определяется константой равновесия реакции, концентрациями реагирующих веществ (обычно скачок тем больше, чем больше концентрация), температурой, природой титруемого вещества и титранта (их константами диссоциации или устойчивости, значениями стандартных окислительно-восстановительных потенциалов, растворимостью), присутствием в системе посторонних веществ и т. п. Знание пределов скачка титрования может существенно помочь в выборе условий проведения реакции и концентрации титранта. Величина скачка титрования должна быть достаточно большой. Увеличить ее можно введением в систему веществ, реагирующих с компонентами, которые определяют свойства системы. Таким путем можно осуществить реакции, не протекающие в обычных условиях. Численное значение свойства в точке эквивалентности необходимо знать для того, чтобы оценить погрешность анализа. Положение точки эквивалентности по отношению к началу и концу скачка титрования зависит от стехиометрического соотношения реагирующих компонентов. Если в уравнении реакции между А и В стехиометрические коэффициенты равны, то точка эквивалентности будет находиться посередине скачка титрования, в противном случае, она будет смещена в ту или иную сторону.
В некоторых лучаях более удобна линейная модель хода реакции титрования, называемая диаграммой титрования. Линейные модели получают в системе координат, в которой на оси ординат отложены равновесные концентрации. Если константы равновесия реакции достаточно велики, то на графике получаются две прямые, пересекающиеся в точке эквивалентности (рис. 3). Линейные диаграммы кислотно-основного титрования позволяют получать дополнительную информацию для разработки методики анализа. На рис.2 приведено сопоставление концентрационно-логарифмической диаграммы, построенной по способу с логарифмической кривой титрования 0,1 н. раствора муравьиной кислоты раствором NaOH. Следует иметь в виду, что реальные кривые и диаграммы титрования несколько отличаются от теоретически рассчитанных. Полный расчет процесса титрования с учетом всех параметров, меняющихся в ходе реакции, сложен и требует применения вычислительной техники.
 | |||
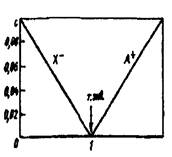 | |||
Рис.2 Рис.3
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1811; Нарушение авторских прав?; Мы поможем в написании вашей работы!