
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Низкоспиновые комплексы (d6) ионов Co3+ и Fe2+ ,имеющие
|
|
|
|
Благодаря такой электронной конфигурации комплексы Cr3+ очень прочны, так как электронные облака t2g-орбиталей располагаются между лигандами и слабо экранируют заряд ядра хрома. Поэтому комплексов Cr3+ известно очень много.
Принято считать, что левее аммиака в спектрохимическом ряду располагаются лиганды “слабого поля”, а правее – лиганды “сильного поля”, дающие при прочих равных условиях большую величину расщепления.
Удовлетворительного обоснования расположению лигандов в этом ряду теория кристаллического поля не даёт. Например, теория не объясняет, почему более полярные лиганды, в частности, Н2О,(m =1,85D) дают более слабое поле, чем менее полярные,например,NH3(m =1,47 D).
Если общее число электронов, находящихся на d–орбиталях центрального атома, не превышает трёх, то они размещаются на орбиталях более низкого энергетического уровня по правилу Хунда. Например, три d-электрона иона Cr3+ в октаэдрическом поле занимают три d–орбитали с низкой энергией (t2g): t2g3eg0 .
При наличии в ионе-комплексообразователе числа электронов, превышающего число орбиталей с низкой энергией, возможны
два варианта заполнения орбиталей электронами. В случае слабого поля энергетически более выгодным оказывается равномерное распределение d-электронов по всем d–орбиталям в соответствии с правилом Хунда. В этом случае центральный ион сохраняет высокое значение спина, так что образуется высокоспиновый парамагнитный комплекс (например: [FeF6]3- (рис.21).
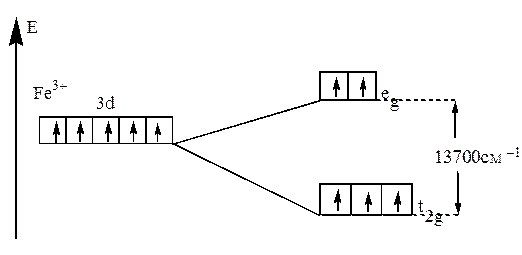
Рис.21. Распределение d-электронов по орбиталям иона Fe3+
в октаэдрическом комплексе [FeF6]3-.
В случае же сильного поля энергетически более выгодным будет размещение максимального числа электронов на t2g -орбиталях, при этом образуется низкоспиновый диамагнитный комплекс(например: [Fe(CN))6]3- (рис.22).
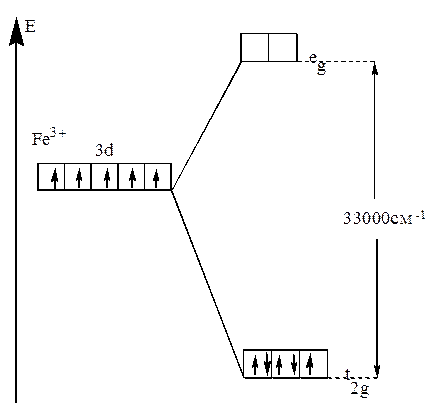
Рис.22. Распределение d-электронов по орбиталям иона Fe3+
в октаэдрическом комплексе [Fe(CN)6]3-.
Табл.1 показывает, что подразделение комплексов на высокоспиновые и низкоспиновые имеет смысл только в случае электронных конфигураций d4,d5,d6 и d7 ..
Таблица 1. Электронные конфигурации комплексообразователя в октаэдрических комплексных соединениях в слабом и сильном полях
| Электрон- ная кон- фигурация | Распределение электронов по подуровням в слабом поле | Максим. спин | Распределение электронов по подуровням в сильном поле | Максим. спин |
| d1 | t2g1eg0 | 0,5 | t2g1eg0 | 0,5 |
| d2 | t2g2eg0 | 1,0 | t2g2eg0 | 1,0 |
| d3 | t2g3eg0 | 1,5 | t2g3eg0 | 1,5 |
| d4 | t2g3eg1 | 2,0 | t2g4eg0 | 1,0 |
| d5 | t2g3eg2 | 2,5 | t2g5eg0 | 0,5 |
| d6 | t2g4eg2 | 2,0 | t2g6eg0 | 0,0 |
| d7 | t2g5eg2 | 1,5 | t2g6eg1 | 0,5 |
| d8 | t2g6eg2 | 1,0 | t2g6eg2 | 1,0 |
| d9 | t2g6eg3 | 0,5 | t2g6eg3 | 0,5 |
| d10 | t2g6eg4 | 0,0 | t2g6eg4 | 0,0 |
Стереохимия соединений d-элементов определяется теми же принципами что и для остальных элементов, т.е. тенденцией электронных пар занимать положения с минимальным взаимодействием между собой. Но для d –элементов приходится учитывать дополнительное влияние несвязывающих электронов на (n -1)d- орбиталях. Если несвязывающая
(n -1)d- конфигурация симметрична по отношению к октаэдрическому полю лигандов, то все шесть лигандов будут отталкиваться в одинаковой степени, и следует ожидать правильного октаэдрического строения. Такими конфигурациями являются:
do, например Ti+4 в [TiF6]4-
t2g3 , например Cr+3 в [Cr(C2O4)3]3-
t2g3 eg2(высокоспиновая),
например Mn+2 в [MnF6]4-
Fe+3 в [FeF6]3-
t2g6 (низкоспиновая),
например Fe+2 в [Fe(CN)6]4-
Co+3 в [Co(NH3)6]3+
t2g6eg2 , например Ni+2 в [NiF4]2- и [Ni(NO2)4]4-
t2g6eg4, например Zn+2 в [Zn(NH3)6]2+
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 2377; Нарушение авторских прав?; Мы поможем в написании вашей работы!