
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Концентрация и активность. Ионная сила раствора
Лекция 2. Общие теоретические основы анализа. Теория электролитической диссоциации. Буферные растворы.
Цель: Показать теоретические основы анализа и приложимость теории электролитической диссоциации к анализу веществ. Показать основные буферные системы, применяемые в аналитической химии.
Концентрацию, в зависимости от раствора выражают следующими способами:
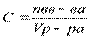
молярная
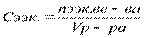
эквивалентн.
Если используемые вещества являются электролитами, то их состояние характеризуется степенью диссоциации L.
Активность - та эффективная кажущаяся концентрация ионов в растворе, в соотношении с которой он проявляет себя в химической реакции.
Активность связана с концентрацией в соотношении: a=f*c, где f - коэффициент активности.
Значение коэффициента активных ионов определяется только ионной силой раствора, и не зависит от природы других ионов, присутствующих в растворе- закон ионной силы Льюиса и Рэндала.
Ионная сила при этом характеризует общее содержание ионов в растворе и рассчитывается как
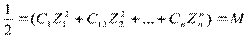
Лекция 3. Кислотно-основные равновесия и их роль в аналитической химии. рН растворов. Индикаторы. рН перехода. Кислотно-основное титрование.
Цель: Показать особенности применения кислотно-основного равновесия в аналитической химии. Показать основные индикаторы и принцип их действия. Сформировать понятие о рН переходах.
|
|
Дата добавления: 2014-01-03; Просмотров: 666; Нарушение авторских прав?; Мы поможем в написании вашей работы!