
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическое равновесие. Константа химического равновесия (концентрационная, термодинамическая, условная). Равновесная концентрация. Понятие об аналитической концентрации
|
|
|
|
Концентрация веществ, имеющая место в системе с момента наступления равновесия, называется равновесной. Эти концентрации остаются неизменными столько долго, сколько не изменяется внешние условия.
Равновесная концентрация вещества зависти от его исходной концентрации и расхода вещества на протекание реакции до момента установления равновесия.
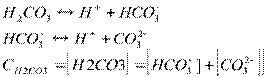
т.о. аналитическая концентрация - это общая концентрация вещества в растворе, независимо от формы его содержания (ионы, молекулы).
Для обратимых реакций А+В↔С+Д закон действия масс записывается в виде константы равновесия
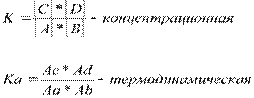
4. Теории кислот и оснований (Аррениуса, Льюиса, Бренстеда-Лоури)
Одной из первых теорий, объясняющих природу кислот и оснований явилась теория электролитической диссоциации Аррениуса-Оствальда. Согласно ей кислотой является электронейтральное вещество, которое при диссоциации в воде в качестве катиона образует только ионы водорода Н+.
НА↔Н++А-
А основанием является вещество, которое при диссоциации образует в воде в качестве аниона только гидроксид-ионы
NaOH→Na++OH-
Однако некоторые вещества проявляют свойства кислот и оснований, то пришла на смену данной пришла протолитическая теория кислот и оснований - Бренстеда-Лоури, согласно которой кислотой является любое вещество, способное отдавать протон, а основанием способное принимать протон.
Многие соли в водных растворах ведут себя как кислоты, хотя Н+ в их составе нет. Эти факты были объяснены в теории Льюиса, но она не нашла широкого применения.
5. Протолитическая теория: анализ роли растворителя. Классификация растворителей.
Теория Бренстеда-Лоури, согласно которой кислотой является любое вещество, способное отдавать протон, а основанием - способное принимать протон.
Растворитель является не только средой, но и реагентом процесса.
Растворители:
1. Протонные - могут отдавать или принимать протон.
Кислотные - способны отдавать протон, основные - способные присоединять протон. Все растворители - амфотерны.
2. Апротонные – не обладают донорно-акцепторными свойствами по отношении к протону.
Если вещество взято в качестве растворителя, то в зависимости от того, какая тенденция отдача или присоединение протона у него преобладает, оно может различным образом влиять на ионизацию растворенного вещества. По влиянию на кислотно-основные свойства растворители делят на: невелирующие и дифференцирующие.
6. Автопротолиз растворителей. Влияние растворителей на силу кислот и оснований.
Автопротолизу подвергаются амфотерные растворители.
Если вещество взято в качестве растворителя, то в зависимости от того, какая тенденция отдача или присоединение протона у него преобладает, оно может различным образом влиять на ионизацию растворенного вещества.
Автопротолиз растворителей протекает в незначительной степени, в растворе наступает равновесие, которое описывается константой:
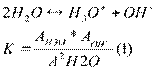
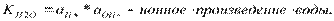
Это важнейшее выражение, свидетельствующее о том, что в любом растворе имеются как ионы водорода, таки гидроксид-ионы.
Реакция среды: рН=-lgaH+,рН=7 в нейтральном растворе, рН<7 в кислом, pH>7 в щелочном растворе.
Аналогично водородному определяют гидроксильный показатель рОН=lgaОН+
А выражение часто записывают в логарифмической форме: рН+рОН=14
8. Равновесие в водных растворах сильных и слабых кислот и оснований. Расчет рН.
1.Когда слабые кислоты диссоциируют в незначительной степени, то в растворе наступает равновесие: НА↔Н++А-
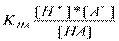
Оно описывается константой диссоциации. Значение констант диссоциации содержатся в справочниках.
2. Сильные кислоты в водных растворах диссоциируют практически нацело
НА→Н++А- концентрация ионов водорода совпадает с общей концентрацией кислоты в растворе, а рН=[H+]=Cк, рН=-lg[H+]=-lgCk
3. Сильные основания (щелочи) диссоциируют нацело ВОН→В++ОН-
4. Слабые основания - диссоциируют в незначительной степени и этот процесс описывается соответствующей константой, которая называется константой диссоциации слабого основания: ВОН↔В++ОН-
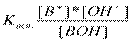
5. Буферные р-ры. Механизм буферного действия, понятие буферной емкости. Расчет рН.
Существуют растворы, при добавлении к которым небольшого количества кислоты или щелочи, или при их разбавлении рН изменяется незначительно. Это буферные р-ры. А указанная их способность поддерживать рН практически постоянным называется буферным действием.
Буферным действием обладают смеси следующего типа:
1.Смесь слабой кислоты и соли с одноименным анионом. CH3COOH+CH3COONa
2. Смесь слабого основания и соли с одноименным катионом NH3+NH4Cl
3. Смесь слабой многоосновной кислоты различной степени замещенности NaH2PO4+Na2НPO4
Буферное действие растворов характеризуется буферной емкостью. Это то минимальное количество сильной кислоты или щелочи, которое необходимо добавить к 1 л буферного раствора, чтобы его рН изменилась на единицу.
рН буферных растворов зависит от константы диссоциации слабой кислоты или основания и от компонентов буферного раствора.
[H+]= Ккисл*(Скисл./Ссоли)
[ОH-]= Косн.*(Сосн../Ссоли)
Лекция 4. Гетерогенные равновесия в системе «осадок – насыщенный раствор малорастворимого электролита» и их роль в химическом анализе.
Цель:Сформировать понятия о применимости гетерогенных равновесий в аналитической химии.
10. Равновесие в водных растворах гидролизующихся солей. Расчет рН.
Расчет рН в растворах солей:
1. Гидролиз по аниону
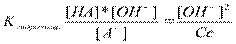
Для расчета рН в растворе соли удобнее пользоваться следующей схемой:
а) написать уравнение реакции гидролиза,
б) указать концентрации ионов,
в) выразить рОН, затем рН
2) При гидролизе по катиону
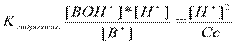
3) В случае совместного гидролиза по катиону и аниону
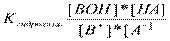
Лекция 5. Окислительно-восстановительное равновесие и его роль в аналитической химии.
Цель: Сформировать понятие о применении окислительно-восстановительного равновесия в аналитической химии. На примерах показать особенности такого применения.
11. Понятие об окислительно-восстановительной системе. Окислительно-восстановительный потенциал (ОВР). Уравнение Нернста.
Признаком ОВР является переход электронов от одних частиц к другим.
Например: 2Fe2++Sn2+→2Fe2++Sn4+
Электрон переходит от ионов олова (восстановитель) к ионам железа (окислитель).
Каждую ОВР можно представить как сумму полуреакций: восстановление - окислителя и окисление-восстановителя.
Роль окислителя заключается в присоединении электрона, а роль восстановителя в их отдаче, то т.о. различие в силе окислителей и восстановителей связана с их способностью к присоединению или отдаче электрона.
Чем легче атом, ион, молекула отдает электрон, тем он является более сильным восстановителем, и наоборот, чем больше средство к электрону, тем более сильным окислителем она является.
Количественно эту активность характеризуют значением Е-потенциала.
ОВ систему или редокспару записываютт: Fe3+ /Fe2+, Sn4+ / Sn
Потенциал отдельных редокспар изменить невозможно, но можно составлять гальванические элементы, комбинируя редокспары с одной и той же системой, условно принятой в качестве стандартной. Такой стандартной системой является система (2Н+/Н2).
Потенциал ОВ пары зависит не только от ее природы, но и от концентрации и активности.
Уравнение Нернста: 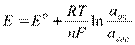
где, Е0 – стандартный ОВ потенциал, R - универсальная газовая постоянная, T - температура в К, n - число электронов участвующих в процессе, F - постоянная Фарадея (96500 Кл/моль), под lg стоит отношение активностей окислительных и восстановительных форм.
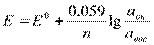
Значение Е называютт реальным ОВ потенциалом системы.
12. Константа равновесия ОВР.
Возможность протекания ОВР в противоположн.направлении свидетельствует о ее обратимости. Обратимые хим.р-ции хар-ся константой равновесия. ОВ потенциалы соответствующих редоксопар опр-ся Ур-ем Нернста.
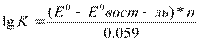
где, n- общее число электронов переходящих от ок-ля к восст-лю.
Применение ОВР в анализе многообразно: для обнаружения ионов, для количественного обнаружения ионов, разделения ионов, устранения мешающих анализу ионов.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 3669; Нарушение авторских прав?; Мы поможем в написании вашей работы!