
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Понятие органич.реагентов. теоретические основы их действия
|
|
|
|
Устойчивость комплексных соединений
Комплексные соединения, их строения и типы. Внутрикомплексные соединения.
Под органич.реагентами понимают органич.соединения, применяемые в анализе для след.целей:
1. качественное и количественное обнаружение ионов.
2. разделение ионов.
3. маскирование.
Широкое применение реагентов обусловлено их достоинствами в сравнении с неорганическими:
1. высокая селективность.
2. высокая чувствительность (опр-е малое кол-во ионов в разбавленных р-рах)
3. большое кол-во доступных реагентов и возм-ть изменения их свойств.
Впервые реагенты были предложены для применения в анализе Илинским, кот.в кач.реагента ан ионы Со предложил использовать органические.
Неск.позже Чугаевым был предложен диметилглиаксин для опр-я ионов Ni.
Св-ва органич.реагентов зависят от присутствия в их молекулах опр.атомных групп, обладающих кислотными св-ми.
Атомы водорода входящие в их состав способны замещаться атомами Ме. Кроме того в молекуле органич.реагента присутствует др.группа атомов, обладающих неподделенной электронной парой. Поэтому катион Ме одновременно образует донорно-акцепторую связь с указанным атомом.
Лекция 6. Предмет и методы количественного анализа. Гравиметрический анализ.
Цель: Сформировать понятие о классификации методов аналитической химии. Сформировать понятие о гравиметрическом методе анализа.
16. Классификация методов анализа. Требования к методам анализа и к результатам.
Анализ ве-в проводится для установления количественного и качественного состава ве-в.
Качественный анализ- позволяет установить, из каких эл-тов состоит ве-во.
Количественный – позволяет установить количественное содержание составных частей в анализируемой среде.
Методы м/классифицироваться в зависимости от кол-ва анализируемого ве-ва:
- Макрометоды,
- Полумикрометоды
- Микрометоды
- Ультрамикрометоды
- Субмикрометоды (очень важны в медицине, биологии).
В зависимости от техники выполнения анализа:
- Химические- в основе хим.реакция.
- Физико-химические- о составе анализируемого ве-ва судят по физ.св-ву продукта (плотность)
- Физические- судят по физическому свойству.
Четкой границы м/у физич. и физич.-хим. р-ции нет, а объединяет их то, что и там и там исследуются св-ва при пом.прибора.
17.Аналитич.реакции и реагенты, требования к ним. Сп-бы повышения селективности и чувствительности
Реагент- ве-во, вызвавшее аналитическую реакцию.
Аналитические р-ции м/осуществляться двумя способами:
- Мокрым- хим.р-ция осуществляемая м/у растворами исследуемого ве-ва и реагента. Она проводится на фильтр.бумаге, предметном стекле с посследующим рассмотрением формы образовавшихся кристаллов.
- Сухим- прокаливание, пирохимические р-ции.
Хим.методы количественного анализа: гравиметрические (весовые), титриметрические (объемные).
Требования методов анализа: 1.чувствительность- определение возможно меньших количеств ве-в.
2. силективность-из большого кол-ва находящихся в образце метод д/определить одно единственное.
3. экспрессность- время затраченное на анализ д/быть минимальным
18.Дробный и систематический анализ ионов, групповой реагент.
Дробный анализ - обнаружение ионов при помощи специфических раствориетлей в необходимых порциях исследуемого р-ра.
Систематический
Последовательность обнаружения ионов м/б различной.
Если специфические р-ции отсутствуют, обнаружение ионов этим методом невозможно. Разрабатывается опр.последовательность реакций обнаружения отд.ионов.
Например, р-р содержит ионы Ca2+ и Ва2+ . Чувствительной реакцией на ионы Са явл. образование осадка Ca2+ +С2О42- →СаС2О4 также и опр-т ионы Ва Ва2+ +С2О42- → ВаС2О4
Значит, в присутствии Ва обнаружить СА невозможно.
В связи с многообразием ионов их обычно отделяют от р-ра не по одиночке, а целыми группами, например, добавление соляной к-ты вызывает осаждение ионов серебра, ртути. Такой реагент наз-т групповым.
Требования: 1. ионы д/осаждаться практич.полностью.
2. избыток реагента не д/мешать обнаружению остальных ионов в р-ре.
3. образ-ся осадок должен быть раст-н в кислотах.
19. Подготовка образца к анализу: понятие средней пробы, ее представительность, Сп-бы отбора, вскрытие.
В ходе анализа м/выделить след.этапы:
1. отбор и усреднение пробы, взятие анвески.
2. разложение пробы.
3. разделение опр.компонента.
4. количественное определение.
5. расчет результатов.
Иногда в анализа реализуются не все этапы, а некот.из них.
Однако в любом случае необходимо отобрать от образца опр.кол-во ве-ва, таким образом, чтобы рез-т анализа показывал состав всего ве-ва. Это небольшое кол-во анализируемого ве-ва, кот.по всем показателям идентично основной массе наз-ся средней пробой. Основное требование к ней представительность, т.е ее состав д/б идентичен среднему составу исследуемого образца.
Сп-бы отбора:
1. если ве-во однородно и в жидком или газообр.состоянии, его перемешивают по всему объему и отбирают небольшое кол-во для анализа.
2. твердые сыпучие ве-ва перемешивают и отбирают среднюю пробу методом «конверта», насыпают и отбирают пробу в указанных точках.
3. в тв.несыпучих ве-х образец сверлят равномерно по всему объему и для анализа берут стружку.
Вскрытие перевод всех определяемых компонентов в удобное для анализа состояние (1.мокрое- растворение пробы в подходящем растворителе- вода, кислоты, 2.сухое- исп-ся когда подобрать растворитель невозможно-прокаливание,)
20. Гравиметрич.метод анализа, сущность, виды. Механизм образования осадка. Условия образования кристаллич.и аморфных осадков.
Гравметрический м-д анализа- основан на точном измерении массы навески выделенной либо в чистом виде, либо в виде соединения определенного раствора.
Взвешивание произв-ся на аналитич.весах с точностью до 0,0001 гр. Результат анализа проводится с округлением до сотых 0,01 гр.
- Метод отгонки- определяемую составную часть образца отгоняют накаливанием, нагреванием.
А) прямой м-д отгонки
Б) косвенный.
Методы отгонки явл.универсальными и имеют ограниченное применение.
- Метод осаждения- определяемый эл-т переводят в труднорастворимое соединение и по массе образовавшегося осадка расчитывают его содержание, выражая это содержание в % от массы исходного образца.
Стадии: I. Растворение-навеску переводят в раствор.
II. Осаждение- определяемый компонент осаждают в виде малорастворимого соединения.
III. Отделение осадка- отд.осадок от раствора фильтрованием и промывают.
IV. Прокаливание- осадок высушивают или прокаливают и точно взвешивают.
V. Расчет результата- по массе осадка и его форме рассчитывают содержание в нем компонента и выражают это содержание в %.
Вид осадка зависит как от индивидуальных свойств веществ, так и от условий осаждения.
Чаще всего работают с аморфными осадками, т.к кристаллич.не всегда можно получить.
21. Формы осадка, требования к ним и к осадителю.
На стадии прокаливания многие осадки претерпевают хим.превращение:
- Осаждаемая форма- то соединение, в виде которого определяемый ион осаждается из раствора.
- Весовая форма- то соединение, которое взвешивают для получения окончательного результата.
Опред.ион соединитель осаждаемая ф-ма весовая ф-ма
SO42- + Ba2+ → BaSO4 ↓ → BaSO4
Требования к осаждаемой форме: малая растворимость, крупнокристаллическая структура осадка, возм-ть легко и полностью переходить в весовую форму.
Требования к осадителю: специфичность, летучесть.
22. Загрязнение осадка.
Образующийся в анализе осадок практич. всегда явл.загрязненным, т.е содержит примеси посторонних веществ.
Соосаждение
механизмы протекания соосаждения:
1. адсорбция- осаждение примесей на поверхности формирования осадка.
2. окклюзия- захват примеси внутрь осадка, при его быстрой кристаллизации.
3. изоморфизм- образование смешанных кристаллов.
4. образование хим.осаждений.
Послеосаждение (1,3,4).
Для удаления примесей используют приемы:
1.промывание осадка
2.созревание осадка
3.перекристаллизация
Лекция 7. Объемный (титриметрический анализ).
Цель: Сформировать понятие об объемных методах анализа. Дать их классификацию.
23.Сущность титриметрического.метода анализа. Требования к реакциям в титриметрии. СП-бы фиксирования точки экв.
Титриметрический метод анализа основан на точном измерении объема реагента, затрачиваемого на реакцию с определяемыми ионами.

Виды титр.м-да анализа:
- кислотно-основное
- окислительно-восстановительное
- комплексо-метрическое
- осадительное.
По способу титрования: прямое, обратное, заместительное.
В ходе анализа требуется точно заметить момент наступления эквивалента, или зафиксировать точку экивалентности.
1 индикаторный- в реакц.смесь + индикатор, кот.в точке экв.меняют цвет.
2 безиндикаторный- если титрант окрашен, то добавляют или его избыток, и появляется неисчезающее окрашивание р-ра.
В титр.методе р-ции должны: протекать быстро, количественно, д/существовать возм-ть фиксировать точку эквивалентности, д/отсутствовать побочные реакции.
24.Кислотно-основное титрование, сущность метода, виды, оласть применения. Построение кривых титрования.
Относятся методы, в основе которых лежит реакция нейтрализации.
Н++ОН-→Н2О
Различают: Ацидиометрию- определение оснований, титруя их кислотами.
Алкалиметрия- щелочами.
Метод исп-ся для определения сильных и слабых кислот и оснований, солей подвергающихся гидролизу.
Характеристикой р-ра, изменяющегося в ходе кисл.-осн.титрования явл. рН.
Кривая, показывающая изменение рН р-ра, изменяющаяся в зависимости от раствора прибавленного титранта наз. Кривой кислотно-основного титрования. В основе метода лежит скачок рН.
25.Кислотно-основные индикаторы. Ионно-хромофорная теория индикаторов.
Для фиксирования точки экв-ти в р-р + спец.ве-во индикатор.
К индикаторам осн.-кисл.титр-я предъявляют след.требования.
1. окраска индикатора д/б интенсивной.
2. окраска индикатора при близких значениях рН д/сильно различаться.
3. изменение окраски д/происходить в узком интервале рН.
4. изменение окраски д/б обратимым.
Титр-е предст.собой слабые органические кислоты или основания, у которых неонизированные молекулы и ионы имеют разл.окраску.
Изменение окраски инд.происходит не при всяком изменении рН, а лишь внутри опр.интервала значений рН, кот.наз. интервалом перехода индикатора.
Середина этого интервала при кот. заканчивается титрование с данным индикатором наз. его показателем титрования.
Фенолфталеин 9,0 рТ
Лакмус 7,0 рТ
Метил.красн. 5,5 рТ
Метил.оранж. 4,0 рТ.
Показатель титрования д/находится в области скачка на кривой титрования!!!
Экстракция –процесс избирательного растворения отдельных компонентов смеси ве-в в каком-либо растворителе.
27. Примеры окислительно-восстановительного титрования:перманганатометрия. Возможности метода, особенности фиксирования точки экв-ти.
Для опр-я многих неорганич.и органич.ве-в исп-т перманганат калия.
1. прямой метод титрования- когда р-ция происх.в сильно кислом р-ре.
2. косвенное- когда ионы осаждают в виде оксалатов, затем титруют перманганатом связанную с Ме щавелевую к-ту или ее избыток, введенный в р-р при осаждении.
Многие органич.ве-ва так же окисляются перманганатом, но р-ция обычно протекает медленно и исп-т косвенное титр-е.
При титр-ии перм. Обычно не используют индикаторы, т.к окраска и так достаточно выражена для установления точки эквивалентности.
Преимущества метода:
1. исходные стандартные р-ры перм.окрашены в малиновый цвет, поэтому точку экв.можно определить по цвету-прямым миетодом, или по бесцветной окраске-косвенным методом.
2. титр-е м/осуществлять в кислой или щелочной среде.
3. перм.явл.дешевым и доступным реагентом.
Недостатки:
1. исх.реагент перм.калия трудно получить в чистом виде.
2. некот.р-ции протекают при комн.темп.медленно.
3. стандартные р-ры перм.не очень устойчивы.
28. Примеры окислительно-восстановительного титрования: иодометрия. Возможности метода, особенности фиксирования точки экв-ти.
иодометрия-метод анализа, при котором о кол-ве определяемого ве-ва судят по кол-ву поглащенного или выделенного иода.
Окислитель-иод, кот.всупает в р-цию с некот.восстановителями.
J2+2e↔2J-
Опр-е иод.методом проводят как прямым, так и обратным титрованием. Кол-во выделившегося иода определяют титрованием его р-ром тиосульфата натрия.
Очень чувствительным явл.р-р крахмала.
Если к р-ру какого-либо восст-ля+ р-р иода, то в точке экв. От линии кпли иода р-р в присутствии крахмала приобретет неисчезающую синюю окраску. Но при постепенном добавлении восст-ля к р-ру иода окраска будет исчезать.
В иодометрии нужно иметь рабочий р-р иода для определения восстановителя.
Лекция 8. Методы осаждения и комплексометрии.
Цель: Сформировать понятия о методах осаждения и комплексообразования и особенностях их применения для анализа различных веществ.
29. Комплексонометрическое титрование, комплексометрическое титр-е. построение кривых титрования, фиксирование точки экв-ти.
комплексонометрическое титрование основано на реакциях комплексообразования
растворы ве-в, способные образовывать комплексные соединения это титранты. Среди них исп-ся ткаие комплексообразователи, как J-, Cl-, Cr- и т.д.
В кач.титрантов исп-т растворы комплексонатов (этилен, тетроуксусная к-та и ее соли).
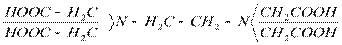
комплексон 2
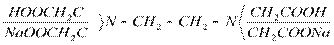
Использование комплексонов в титриметрии выделило этот СП-б титрования в отд.область комплексометрического титрования-комплексонометрическое титрование.
Осн.хар-кой р-ра явл.концентрация ионов Ме в нем.
Кривая титрования строится в координатах.
Для фиксирования точки экв.исп-ся так наз.металоиндикаторы, кот.явл.органич.красителями, образованными ионами Ме. Окрашенные комплексные соединения менее прочны, чем компл-с Ме с комплексоном.
Комплексоны не явл.спец.реагентами, поэтому увеличить силиктивность их действия, т.е определить ионы в присутствии других, можно лишь с изменением рН р-ра.
30. Атомная эмиссионная спектрометрия. Качественный и количественный спектральный анализ.
атомная эмиссионная спектрометрия-физич.метод определения хим.состава ве-ва по его спектру, испускаемому возбуждаемыми атомами.
Суть метода: устройство для ввода пробы + источник возбуждения (пламя горелки). Под воздействием высоких температур растворитель испаряется, а ве-во перводится в атомароное сот-е, и атомы возбуждаются. Затем атомы возвращаются в исходное сотояние, испуская при этом избыточную энергию. Это излучение проходит ч-з диспергирующий элемент, где оно разлагается в спектр, после чего улавливается фотоэлементом.
Вид спектра явл.качественной хар-кой ве-ва, а интенсивность линий спектра явл.количественной хар-кой.
Т.к число линий атомов в спектре велико, то для аналитич.цепей исп-ся не все линии, а лишь некоторые из них-это так наз.аналитические линии.
Лекция 9. Хроматографические методы анализа. Оптические методы анализа. Электрохимические методы анализа.
Цель: сформировать понятия о многообразии инструментальных методов анализа, калибровки приборов, особенностей применения методов.
31.Атомно-абсорбционная спектрометрия, сущность метода
Метод основан на поглощении лучей атомами в газовой фазе, образующийся в пламени, при распылении в нем исследуемого р-ра.
Метод предполагает создание слоя поглощающего атомного пара, пропускание пучка лучей ч-з слой, разложение прошедшего потока в спектр и измерение оптич. плотности.
Концентрацию Эл-та м/находить по методу градуированного графика
32. Понятие о других спектральных методах анализа: люминесцентный, рефрактрометрический.
Люминесцентный.
В опр.условиях поглащенная атомами энергия м/выделяться в виде лучистой энергии. Люминесцентное свечение м/б вызвано действием разл. видов энергии. Свечение ве-ва м/происходить под влиянием бомбардировки его потоком электронов- катодными лучами. Такое свечение наз-ся катодо-люминисценцией, оно исп-ся в лампах дневного света. Под влиянием энергии хим.реакции м/происходить свечение, называемое химиялюминисценцией. Свечение м/б вызвано поглащением лучистой энергии- фотолюминисценция.
По хар-ру люминисцентного свечения различают фосфоросценцию (свеч.продолжающееся после удаления источника свечения) и фиуоросценцию (свеч.прекращающееся сразу же после удаления источника возбуждения свечения).
Все эти виды свечения схожи по своей природе и объединяются общим понятием – люминисценция.
Рефрактометрический основан на определении показателя (коэф-та) преломления исследуемого ве-ва.
Если луч света переходит из одной среды в другую, то он частично отражается от поверхности раздела, а частично преломляется.
Показателем преломления наз-т отношение sin угол падения луча света к sin угла его преломления.
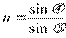
33. Электрохимические методы анализа, обзор, краткая хар-ка.
Основаны на взаимодействии ве-ва с эл.током.
1. электровесовой- определяемый эл-т выделяют электролизом. Хар-ся высокой точностью, применяется для определения компонентов сплавов. Недостаток-энергоемкость, непродолжительность по времени.
2. кулонометрический- основан на измерении кол-ва электричества, затраченного на р-цию с определяемым ионом. Расчеты ведутся по з-ну Фарадея.
3. кондуктометрический- основан на измерении электропроводности исследуемого р-ра.. ЭС-электропроводность опр-ся суммарным соединением всех ионов.
4. потенциометрический
5. полярографический
6. амперометрическое титрование- в кач.индикаторного электрода исп-ся полярографич.устр-во
34. Потенциаметрические методы анализа
Измерения проводят в так наз.эл.хим.ячейке, это система из 2х электродов, погруженных в исследуемый р-р и соединенных с измерительным прибором.
По роли в анализе электроды:
- индикаторный-электрод, потенциал которого зависит от концентрации определяемых ионов в исследуемом р-ре. Исп-ся в кач.электрода стеклянный, металлический э-д.
Ур-е Нернста: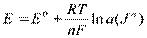
- электрод сравнения-потенциал его постоянен, независимо от протекания какой-либо р-ции в р-ре.
|
|
|
Дата добавления: 2014-01-03; Просмотров: 443; Нарушение авторских прав?; Мы поможем в написании вашей работы!