
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция №9. Необратимое ингибирование ферментов: действие йодацетамида, который ингибирует ферменты, содержащие в активном центре сульфгидрильные группы
|
|
|
|
Необратимое ингибирование ферментов: действие йодацетамида, который ингибирует ферменты, содержащие в активном центре сульфгидрильные группы.
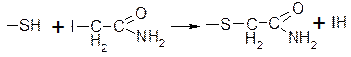
Происходит блокирование этой группы и ковалентное взаимодействие.
Обратимое ингибирование ферментов предполагает нековалентное связывание ингибитора с ферментным и по своей природе может быть
§ конкурентное;
§ неконкурентное;
§ бесконкурентное.
Конкурентное ингибирование – ингибитор конкурирует с субстратом в активном центре.

Происходит расщепление субстрата. Ингибитор конкурирует с субстратом за активный центр, т.е. какой-то частью он структурно напоминает субстрат, как бы включается и образуется фермент-ингибиторный комплекс, субстрат уже сюда включиться не может. Чтобы снять это влияние, необходимо повысить концентрацию субстрата, он будет вымывать фермент из этого комплекса.
 |
Примером может служить действие фермента сукцинатдегидрогиназы на янтарную кислоту:

Вступать в реакцию могут кислоты, имеющие две карбоксильные группы (щавелево-уксусная кислота, малоновая кислота).
Неконкурентное ингибирование: ингибитор связывается с ферментом не в активном центре, а где-то в другом месте, при этом меняется структура активного центра, активный центр становится непригодным для связывания субстрата.

Отличить конкурентное ингибирование от неконкурентного ингибирования можно обнаружить снятием скорости ферментативной реакции от

С увеличением концентрации ингибитора возрастает константа Михаэлиса, т.е. необходимо увеличить концентрацию субстрата, чтобы насытить фермент.

Если же ингибирование неконкурентное, тогда вид зависимости будет иным, будет изменяться максимальная скорость.
[I0] < [I1] < [I2]
Бесконкурентное ингибирование – ингибитор взаимодействует уже с образовавшимся с фермент-субстратным комплексом, образуется ингибиторно-фермент-субстратный комплекс, дальше катализ не идет.
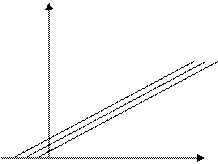
Меняется и константа Михаэлиса и максимальная скорость процесса.
В ферменте всегда можно выделить каталитический центр – это тот участок в ферменте, где происходит непосредственное взаимодействие с субстратом. Его можно условно разделить на две части: собственно каталитический участок и контактная (якорная) площадка, которая обеспечивает специфическое сродство к субстрату. Если фермент – сложный белок, то каталитическую функцию выполняет кофермент, а якорная площадка – уникальная третичная структура белка. Если же фермент – простой белок, то и якорная площадка и каталитический участок определяются уникальной комбинацией радикалов аминокислот в одном месте в ферменте.
Мультиферментые системы.
В клетке многие ферменты как правило работают одновременно, катализируя последовательные цепи реакции, в которых продукты первой реакции являются субстратами для второй реакции и т.д. субстраты и продукты реакции как низкомолекуолярные соединения диффундируют в клетке и быстро находят каждый свой фермент. По сложности молекулярной организации такие мультиферментные системы можно разделить на три группы:
1.  Отдельные ферменты растворены в цитоплазме и работают независимо друг от друга, а субстраты – это малые молекулы, они диффундируют в этой цитоплазме, каждый находит свой фермент и процесс катализа идет.
Отдельные ферменты растворены в цитоплазме и работают независимо друг от друга, а субстраты – это малые молекулы, они диффундируют в этой цитоплазме, каждый находит свой фермент и процесс катализа идет.
Каждый фермент работает самостоятельно, обособлено.
2. 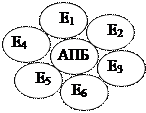 Ферменты образуют общеферментный комплекс, т.е. они объединены в один комплекс. При разрушении такого комплекса активность системы резко падает. Примером является дрожжевая система жирных кислот (синтетаза жирных кислот), в клетках осуществляется синтез высших жирных кислот вплоть до пальмитиновой кислоты.
Ферменты образуют общеферментный комплекс, т.е. они объединены в один комплекс. При разрушении такого комплекса активность системы резко падает. Примером является дрожжевая система жирных кислот (синтетаза жирных кислот), в клетках осуществляется синтез высших жирных кислот вплоть до пальмитиновой кислоты.
АПБ – ацил-переносящий белок
Синтетаза жирных кислот – комплексная мультиферментная система. При таком синтезе даже не нужно АТФ, т.к. синтез происходит с минимальными затратами энергии.
3.  Ферменты связаны с каким-то надмолекулярным образованием, например, дыхательная цепь, которая связана с внутренней мембраной митохондрии. Ферменты этой системы вживлены во внутреннюю мембрану.
Ферменты связаны с каким-то надмолекулярным образованием, например, дыхательная цепь, которая связана с внутренней мембраной митохондрии. Ферменты этой системы вживлены во внутреннюю мембрану.
Мембрана помогает действию этих ферментов. Другой пример – это рибосомы, в них происходит процесс синтеза белка, а все остальные части рибосомы – ферменты.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 354; Нарушение авторских прав?; Мы поможем в написании вашей работы!