
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Виды гибридизаций АО и геометрические параметры частиц
|
|
|
|
Длина связи lА-В (нм) – это расстояние между ядрами химически связанных атомов. Эта характеристика зависит от размеров электронных оболочек и степени их перекрывания. Между длиной связи и ее энергией имеется определенная корреляция: чем меньше длина связи, тем больше энергия связи. Для приближенной оценки длины ковалентной связи в молекуле можно использовать формулу
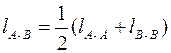 , (3)
, (3)
где 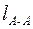 ,
, 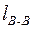 - межъядерные расстояния в молекулах А 2 и В 2. Половина межъядерного расстояния в простой двухатомной молекуле называется ковалентным радиусом атомаrА.
- межъядерные расстояния в молекулах А 2 и В 2. Половина межъядерного расстояния в простой двухатомной молекуле называется ковалентным радиусом атомаrА.
Для веществ, находящихся в кристаллическом состоянии, принято говорить о константе решетки K. Константа решетки - это расстояние между центрами двух соседних структурных частиц в кристалле. В ионном кристалле константа решетки равна сумме эффективных радиусов ионов.
Угол между воображаемыми прямыми, проходящими через ядра химически связанных атомов, называется углом связи или валентным углом. Его определяют с учетом гибридизации центрального атома в молекуле.
§ 2. Ковалентная связь и ее свойства
Ковалентная связь (КС) – тип связи, который возникает при обобществлении электронов взаимодействующих атомов. Для описания такого вида связи используют метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
МВС (иначе метод локализованных электронных пар) основан на следующих положениях:
1. КС образуется двумя атомами за счет перекрывания двух электронных облаков с антипараллельными спинами;
2. Связь располагается в том направлении, в котором будет обеспечиваться наибольшая область перекрывания АО;
3. КС тем прочнее, чем больше область АО.
КС может возникнуть:
1. По обменному механизму за счет объединения одноэлектронных АО внешнего энергетического уровня по одному со стороны каждого атома:

Число одноэлектронных АО может увеличиваться при переходе атома в возбужденное состояние;
2. По донорно-акцепторному механизму за счет объединения пары электронов одного атома (донора) и свободной АО другого атома (акцептора):

Основными свойствами КС являются насыщаемость, направленность и полярность. Общее число КС, которое способен образовать атом, ограничено числом его АО (свободных и занятых), использование которых энергетически выгодно. Для элементов первого и второго периодов энергетически выгодно использование АО только внешнего энергетического уровня. Начиная с третьего и далее периодов кроме s – и p –орбиталей внешнего уровня в образовании КС могут участвовать d –орбитали внешнего и предвнешнего энергетических уровней. Таким образом, максимальное число КС у каждого атома ограничено его валентными возможностями, то есть связь насыщаема.
Для обеспечения наиболее полного перекрывания электронных облаков взаимодействующие атомы вынуждены располагаться в пространстве относительно друг друга определенным образом – направленно. По типу перекрывания (направленности) различают:
1. s -связь – перекрывание АО происходит вдоль оси, соединяющей ядра взаимодействующих атомов, что приводит к возникновению только одной области перекрывания. К образованию такого вида связи способны электронные облака любой формы. Например, s р-р перекрывание образуется таким образом:

2. p- связь – перекрывание АО происходит по обе стороны от оси, соединяющей ядра взаимодействующих атомов, что приводит к возникновению двух областей перекрывания. Например, p р-р перекрывание:

К образованию такого вида связи не способны s -электронные облака;
3. d- связь – перекрывание двух d -орбиталей, находящихся в параллельных плоскостях, с образованием четырех областей перекрывания.
Возникновение p- и d-связей происходит только в том случае, когда взаимодействующие атомы уже связаны s-связью. Наложение p- и d-связей на s-связь приводит к повышению кратности связи (иначе порядка связи n), то есть к уменьшению межъядерного расстояния.
Например, в молекуле N2 между атомами азота связь тройная (NºN) – одна s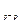 и две p
и две p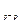 .
.
Направленность КС придает многоатомным частицам определенную форму – конфигурацию, от которой с учетом гибридизации АО зависит внутренняя структура вещества.
§ 3. Гибридизация атомных орбиталей
Гибридизацией АО называют процесс смешения нескольких различных по форме и энергии АО данного атома, который сопровождается образованием такого же числа новых, одинаковых по форме и энергии гибридных АО, располагающихся в пространстве относительно друг друга таким образом, чтобы обеспечить более полное перекрывание с АО соседних атомов в частице.
В процессе гибридизации могут участвовать как одноэлектронные АО, так и АО занятые спаренными электронами. Одноэлектронные гибридные АО способны образовать связи с другими атомами и определяют тем самым геометрическую форму молекулы или иона, поэтому их называют связывающими. Двухэлектронные гибридные АО обычно не участвуют в образовании связей (исключение – донорно-акцепторный механизм), называются несвязывающими (при записи формулы молекулы их обозначают Ё) и не учитываются при выявлении геометрической формы образовавшейся частицы. В табл.5 приведены наиболее распространенные виды гибридизаций АО и формы молекул, которые им соответствуют.
Таблица 5
| Тип гибридизации | Расположение гибридных АО | Угол между связями | Количе-ство Ё | Геометрическая форма и состав молекулы | Пример |
| sp | Линейное | 180° | Линейная АВ2 | BeCl2 | |
| sd | Линейное | 90° | Угловая АВ2 | SrCl2 | |
| sp 2 или sd 2 | Треугольное | 120° уменьшается | Треугольник АВ3 Угловая АВ2Ё | BF3 SnCl2 | |
| sp 3 или sd 3 | Тетраэд-рическое | 109°28/ уменьшается уменьшается | Тетраэдр АВ4 Тригональная пирамида АВ3Ё Угловая АВ2Ё2 | CH4 NF3 H2O | |
| sp 3 d | Тригонально-бипирами-дальное | 90° и 120° ______ 180° и 90° 180° | Тригональная бипирамида АВ5 Неправильный тетраэдр АВ4Ё Т-образная АВ3Ё2 Линейная АВ2Ё3 | PCl5 SF4 ClF3 XeF2 | |
| sp 3 d 2 | Октаэдри-ческое | 90° 90° 90° | Октаэдр АВ6 Тригональная пирамида АВ5Ё Квадрат АВ4Ё2 | SF6
SbF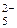 XeF4
XeF4
| |
| sp 3 d 3 или sp 3 d 2 f | Пентагональ-но-бипирами-дальное | ____ ____ | Пентагональная пирамида АВ7 Неправильный октаэдр АВ6Ё | IF7 XeF6 |
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1206; Нарушение авторских прав?; Мы поможем в написании вашей работы!