
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристики химической связи
|
|
|
|
Химическая связь – явление взаимодействия атомов, обусловленное перекрыванием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной энергии системы по сравнению с энергией изолированных атомов. В зависимости от характера распределения электронной плотности между взаимодействующими атомами различают три основных типа химической связи: ковалентную, ионную и металлическую. Кроме того, между атомами соседних молекул могут возникать взаимодействия, такие как водородная связь и вандерваальсовые силы.
Основными характеристиками химической связи являются ее энергия, длина и валентный угол.
Энергия химической связи ЕА – В (кДж/моль) – мера прочности связи, которая определяется работой, необходимой для разрушения данной связи, или энергией, которая выделяется при образовании связи из отдельных атомов. Чем больше ЕА – В, тем прочнее (устойчивее) частица. Для двухатомных простых молекул типа А 2 (например, Н2 или N2) энергия связи равна энергии атомизации молекулы Е атом, т. е. энергии, которая затрачивается на распад 1 моль молекул типа А 2 до атомарного состояния. Для многоатомных молекул типа АВn (например, СН4 или NH3) принято говорить о средней энергии связи 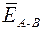 , которая может быть определена по формуле
, которая может быть определена по формуле
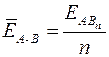 ,
, (1)
(1)
где 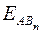 - энергия образования вещества, кДж/моль; n – число однотипных связей (обычно совпадает с числом атомов В в молекуле).
- энергия образования вещества, кДж/моль; n – число однотипных связей (обычно совпадает с числом атомов В в молекуле).
Для расчета энергии одной связи необходимо 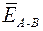 (в кДж/моль) разделить на постоянную Авогадро N А.
(в кДж/моль) разделить на постоянную Авогадро N А.
Энергия химической связи может быть определена по положению границы между линейным и сплошным спектром молекулы. Эта граница характеризует минимальное количество энергии, необходимое для разрыва связи, то есть саму энергию связи. Энергия химической связи и длина волны света связаны между собой выражением
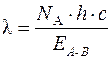 , (2)
, (2)
где h – постоянная Планка; с – скорость света.
Разрыв связи в молекуле может быть осуществлен:
1) гомолитически, то есть с образованием атомов АВ ® А + В;
2) гетеролитически, то есть с образованием ионов АВ ® А z+ + B z-.
При изменении энергий связей в рядах однотипных соединений можно отметить следующие закономерности:
- чем больше разность между электроотрицательностями (DЭО) элементов, тем больше энергия связи между их атомами (правило Полинга);
- чем больше размеры атомов, тем меньше энергия связи;
- энергия связи в кристалле всегда больше, чем в соответствующей молекуле;
- энергия диссоциации по гомолитическому механизму ниже, чем по гетеролитическому.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 376; Нарушение авторских прав?; Мы поможем в написании вашей работы!