
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Массы атомов и молекул
В качестве единичной атомной массы m ат принимается 1/12 массы атома ядра изотопа углерода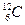 :
: 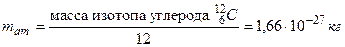
Относительная молекулярная масса, или относительная масса молекулы, есть отношение массы молекулы к единичной атомной массе:
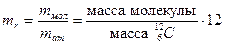
Аналогично определяют и относительную атомную массу.
Абсолютные значения атомных масс по порядку величины заключаются в пределах 10 –25 ÷ 10 –27 кг, а относительные атомные массы в пределах 1÷102. Пределы относительных молекулярных масс mr от 1 до 105.
Количество вещества. Количество вещества характеризуется числом его структурных элементов. В СИ оно выражается в молях. Моль является основной единицей измерения, так же как метр и секунда.
Моль равен количеству вещества рассматриваемой системы, которое содержит столько же структурных элементов, сколько атомов содержится в 0,012 кг изотопа углерода 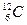 .
.
Понятие моля относится к числу структурных элементов вещества. Поэтому нужно говорить: «моль молекул», «моль атомов», «моль электронов» и т.п.
Таким образом, моль любого вещества содержит одинаковое число структурных элементов. Это число называется постоянной Авогадро или числом Авогадро:
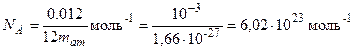
Отсюда следует: 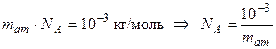
Молярная масса – масса одного моля молекул вещества.
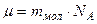
Её определяют через относительную массу молекулы:
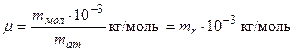
Молярные массы некоторых веществ
| Вещество | Н2 | О2 | Н2О | N2 | Ar | He | Сухой воздух |
| m, кг/моль | 2×10-3 | 32×10-3 | 18×10-3 | 28×10-3 | 40×10-3 | 4×10-3 | 29×10-3 |
Число молей молекул ν связано с числом молекул N некоторого вещества формулой:
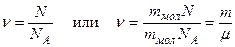 , где
, где 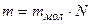 - масса вещества.
- масса вещества.
|
Дата добавления: 2014-01-03; Просмотров: 539; Нарушение авторских прав?; Мы поможем в написании вашей работы!