
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Опытные газовые законы
|
|
|
|
Газовые законы были установлены в 17–18 веках экспериментально. Однако, их можно получить, используя основные положения молекулярно-кинетической теории идеальных газов.
Закон Бойля–Мариотта. Для данногоколичества вещества 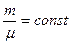 рассмотрим изотермический процесс, то есть процесс, протекающий без изменения температуры (Т= const). Используя уравнения (6.6) или (6.7), получим уравнение изотермы, выраженное через давление и объём газа:
рассмотрим изотермический процесс, то есть процесс, протекающий без изменения температуры (Т= const). Используя уравнения (6.6) или (6.7), получим уравнение изотермы, выраженное через давление и объём газа:
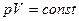 (6.8)
(6.8)
или 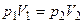 Для данной массы газа при изотермическом процессе произведение давления на объём есть величина постоянная.
Для данной массы газа при изотермическом процессе произведение давления на объём есть величина постоянная.
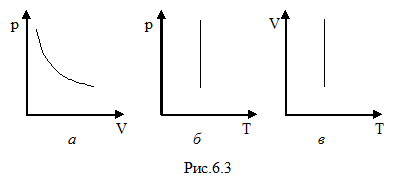 Для построения диаграммы p(V) выразим давление через объем
Для построения диаграммы p(V) выразим давление через объем 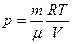 .
.
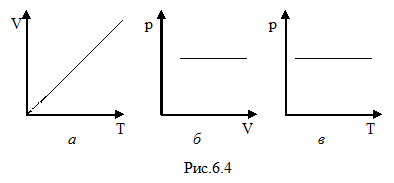
Зависимость между давлением и объёмом – обратно пропорциональная, графически представлена гиперболой на рис.6.3 а. Температурные зависимости давления и объёма представлены на рис.6.3 б и в, соответственно.
 Закон Гей-Люссака. Для данного количества вещества
Закон Гей-Люссака. Для данного количества вещества 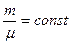 рассмотрим изобарический процесс, т.е. процесс, протекающий без изменения давления (p = const). Используя уравнение (6.6) или (6.7), получим уравнение изобары, выраженное через температуру и объём:
рассмотрим изобарический процесс, т.е. процесс, протекающий без изменения давления (p = const). Используя уравнение (6.6) или (6.7), получим уравнение изобары, выраженное через температуру и объём:
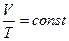 , (6.9)
, (6.9)
через параметры начального и конечного состояния 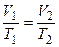 или
или 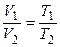 .
.
|
|
|
Дата добавления: 2014-01-03; Просмотров: 4278; Нарушение авторских прав?; Мы поможем в написании вашей работы!