
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Самовозгорание
|
|
|
|
Тепловое самовоспламенение (тепловой взрыв).
Самовоспламенение – это явление резкого увеличения скорости экзо-термических реакций, приводящее к самопроизвольному возникновению го-рения вещества в отсутствии источника зажигания.
Теория теплового самовоспламенения разработана академиком Семе-новым Н.Н., который исходил из представления об ускорении реакций окис-ления с температурой и преобладания скорости тепловыделения над тепло-отводом.
При окислительной реакции, проходящей с полной отдачей образую-щегося тепла, горение не возникает. Горение возникает лишь в условиях рез-кого самоускорения химического процесса, связанного с накоплением либо тепла в системе (так называемое тепловое самовоспламенение), либо катали-зирующих промежуточных продуктов реакции (цепное самовоспламенение). Суть теории заключается в следующем. Рассмотрим поведение горючей сме-си, заключенной в сосуд объемом V с постоянной температурой стенок Т0. В смеси протекает химическая реакция. Температура во всех точках сосуда одинакова и равна Т.
Исходя из физико-химических свойств газов, рассмотренных нами Ра-нее, скорость химической реакций υр подчиняется соотношению
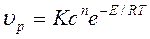 (6.1)
(6.1)
где: К – константа скорости реакций, зависящая от температуры;
с – концентрация реагирующих веществ;
n – порядок реакции;
Е – энергия активации реакции.
Скорость выделения тепла при реакции:
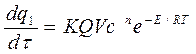 , (6.2)
, (6.2)
где: Q – тепловой эффект реакции;
V – объем сосуда;
τ – время.
Видно, что с повышением температуры скорость выделения тепла рас-тет по экспоненте.
Выделившееся тепло расходуется на нагрев смеси и потери в окру-жающую среду за счет теплопроводности и излучения.
Количество тепла, отводимое от поверхности сосуда в единицу времени выражается линейною зависимостью:
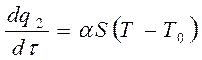 (6.3)
(6.3)
где: α – коэффициент теплоотдачи;
S – площадь поверхности стенок сосуда.
Тогда изменение подвода и отвода тепла в зависимости от температуры можно проиллюстрировать следующим образом (рис. 22):

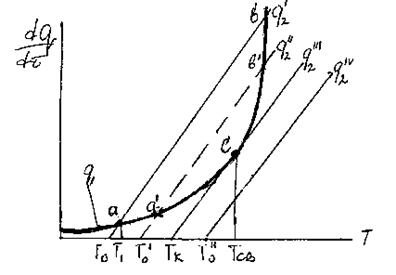
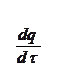
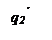

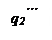


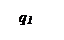

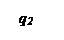
 Рис. 22. Соотношение теп-ловыделения и теплоотво-да при тепловом взрыве.
Рис. 22. Соотношение теп-ловыделения и теплоотво-да при тепловом взрыве.


Три линии q 2 соответствуют трем значениям начальной температуры смеси То, Тк и То’.
Решающим условием возникновения процесса горения является пре-вышение или равенство скорости выделения тепла реакции над скоростью отдачи тепла реагирующей системой в окружающую среду, например, стен-кам реакционного сосуда.
При установившимся состоянии системы q 1= q 2 и температура в сосуде определяется как абсцисса точек пересечения линии q 1 с линиями q 2. Из ри-сунка видно, что линии прихода и отвода могут пересекаться в двух точках (точки a и b) либо в одной точке (точка с), либо не пересекаться.
Рассмотрим первый случай: нагрев смеси, имеющей начальную темпе-ратуру То. При T=Tо скорость теплоотвода по условиям равна нулю и хотя q1 невелико, реагирующий газ начинает нагреваться. С повышением температу-ры и q1 и q2 возрастают. Пока температура газа лежит в интервале между Т0 и Т1 он продолжает нагреваться. При достижении Т1 величины q1 и q2 сравни-ваются и температура газа становится постоянной. Состояние системы в этой точке является устойчивым. Если в результате случайных причин температу-ра газа превысит Т1 то теплоотвод скажется больше тепловыделения и систе-ма сама вернется в прежнее состояние. Если мы искусственно охладим газ, то он нагреется сам за счет реакции до T1. Режим медленной реакции, протее-кающий с практически постоянной скоростью при Т=T1 сохраняется дли-тельное время.
Вторая точка пересечения кривых (b) находится в области больших вы-соких температур, и режим тепловой реакции в этом случае будет неустой-чивым. При отклонении от равновесного состояния в точке b система в него уже не возвращается.
Повышение начальной температуры стенок сосуда То до То' приводит к смещению вправо линии теплоотвода q2. Значение стационарной температу-ры Т1 будет при этом плавно расти (точка а'), и при температуре стенки Тк линии подвода и отвода тепла будут касаться одна другой в точке С, которая является граничной точкой существования стационарного режима, неболь-шое повышение температуры стенки выше Тк будет сопровождаться превы-шением теплоприхода над теплоотводом, что вызовет повышение температу-ры смеси и соответственно, резкое ускорение реакции.
Этот процесс перехода от медленно протекающей реакций к прогрес-сивно ускоряющемуся возгоранию смеси, является процессом самовоспламе-нения. А температура, откладываемая на оси абсцисс от точки С – темпера-тура самовоспламенения Тсв.
Минимальную температуру стенок сосуда Тк, при которой смещение достигнет равенства q1 = q2” – называют критической температурой воспла-менения.
При повышении температуры сосуда до То" условия тепловыделения по-прежнему описываются кривой q1, тогда как прямая теплоотвода q2''' пере- местится вправо параллельно самой себе. При температуре То" сосуда тепло-приход больше теплоотвода при любой температуре газа, и температура газа, а с нею и скорость реакции, будут прогрессивно расти.
Температура сосуда, для которой прямая теплоотвода q2” касательна к кривой тепловыделения, является предельной для перехода от режима мед-ленной реакции к взрыву. При Tо>Tк скорость реакции и температура газа неограниченно увеличиваются и происходит тепловой взрыв. При Tо< Tк ус-танавливается стационарный режим, при котором скорость реакции мала.
Время, в течение которого в реагирующей системе достигается разо-грев от Ткр до Тсв, называется периодом индукции самовоспламенения.
Теория теплового самовоспламенения хорошо объясняет зависимость между давлением и температурой самовоспламенения горючей смеси. До-пустим, что сосуд, в который вводится смесь, имеет постоянную температуру То. При малых давлениях количество выделяющегося тепла не превышает количества отводимого тепла, и реакция протекает при постоянной темпера-туре, близкой к температуре сосуда.
При увеличении давления и соответственно, массы вещества выделяет-ся больше тепла, чем отводится, температура газов повышается и происходит их самовоспламенение. Наглядно зависимость теплоприхода и теплоотвода  (где τ – время), от температуры при различных давлениях показана на ри
(где τ – время), от температуры при различных давлениях показана на ри сунке 23:
сунке 23:
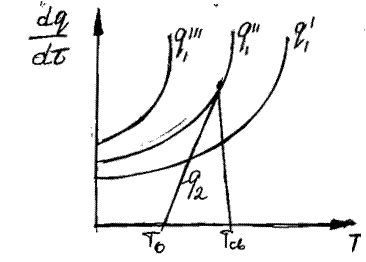
Рис. 23. Соотношение теплопри- хода и теплоотвода при различном давлении газовой смеси: q1' < q1" < q1'''
Тут 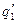
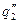
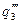 показывают тепловыделение при давлениях соответствен-но Р1<Р2<Р3 при одинаковом составе смеси. Количество отводимого от зоны горения тепла характеризуется прямой q 2 . Критические условия самовоспла-менения реализуются при давлении Р2 (кривая
показывают тепловыделение при давлениях соответствен-но Р1<Р2<Р3 при одинаковом составе смеси. Количество отводимого от зоны горения тепла характеризуется прямой q 2 . Критические условия самовоспла-менения реализуются при давлении Р2 (кривая 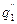 ).
).
Условия самовоспламенения предельного состава горючей смеси пока-зана на кривых 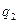 и
и 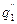 . В общем, условие теплового самовоспламенения сво-дится к тому, что начальный саморазогрев горючей смеси в результате реак-ции окисления должен превысить некоторое критическое значение
. В общем, условие теплового самовоспламенения сво-дится к тому, что начальный саморазогрев горючей смеси в результате реак-ции окисления должен превысить некоторое критическое значение 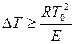 , называемое характеристическим интервалом температуры. Вывод этого по-казателя изложен в § 9.3.
, называемое характеристическим интервалом температуры. Вывод этого по-казателя изложен в § 9.3.
Зависимость температуры самовоспламенения от состава горючей сме-си показана на рисунке 24. Минимальная Тсв характерна для стехиометриче-ских смесей.

Рис. 24. Область самовоспламе-нения горючих смесей.
Самовозгорание представляет собой процесс низкотемпературного окисления дисперсных материалов, заканчивающийся тлением или пламен-ным горением. Склонность к самовозгоранию веществ определяется ком-плексом их физико-химических свойств: теплотой сгорания, теплоемкостью, теплопроводностью, удельной поверхностью, объемной плотностью и усло-виями теплообмена с внешней средой.
Для развития процесса самовозгорания решающее значение имеет воз-можность накопления в материале тепла, выделяющегося при окислении (или деятельности микроорганизмов). Чем лучше условия аккумуляции теп-ла, тем раньше при более низкой температуре начинается самовозгорание.
Процессы самовозгорания развиваются в материалах при довольно низ-кой температуре (до 250оС) в течение длительного времени. В таких услови-ях для поддержания процесса самовозгорания недостаточно тепла, выде-ляющегося при окислении внешней поверхностью. Обязательным условием является вовлечение в реакцию окисления или разложения всей массы мате-риала. И чем больше масса, тем легче развивается в ней процессы самонагре-вания и самовозгорания. Увеличение температуры окружающей среды со-кращает время до самовозгорания.
Можно выделить два механизма самовозгорания:
Тепловое самовозгорание заключается в следующем. Многие дис-персные материалы взаимодействуют с кислородом воздуха уже при обыч-ной температуре. В условиях, благоприятствующих накоплению тепла в мас-се материала, происходит повышение температуры. Это в свою очередь по-вышает скорость реакций окисления, повышая при этом температуру и т. д. В итоге может произойти самовозгорание материала.
Тепловое самовозгорание – физико-химический процесс, скорость ко-торого зависит от скорости химической реакции, поступления кислорода к реагирующей поверхности и от интенсивности теплообмена материала с ок-ружающей средой.
При хранении дисперсных материалов на воздухе кислород проникает вовнутрь материала между частицами. Попадая в поры, кислород адсорбиру-ется в поверхностном слое, что вызывает повышение температуры. Наличие развитой поверхности твердого материала с адсорбированным на ней кисло-родом является необходимым условием для начала теплового самовозгора-ния.
Существенную роль в развитии процесса самовозгорания играют по-ристость и адсорбционная способность материала. Чем больше пор, тем больше развита поверхность контакта и адсорбция на ней кислорода. Поэто-му наиболее склонны к самовозгоранию материалы с большей пористостью.
Саморазогрев массы материала неоднороден. Вследствие разных усло-вий теплоотвода, центральная зона объема нагревается быстрее, чем поверх-ность, и на начальной стадии самовозгорания характерно сохранение внеш-него вида материала, хотя внутри происходит обугливание. Затем на обуг-ленной поверхности развиваются процессы тления, которые могут перейти в пламенное горение. Поскольку промежуточным продуктом при самовозгора-нии большинства органических веществ является уголь, то главную роль иг-рают закономерности самовозгорания угля.
Следует отметить, что значительную роль в самовозгорании угля игра-ет его способность адсорбировать пары воды из окружающего воздуха. Уста-новлено, что при этом уголь может нагреваться до 65-70оС. Например, при адсорбировании 0,01 г Н2О выделится 22,6 Дж тепловой энергии.
Ускорению процесса самовозгорания способствует накопление тепла, развитая поверхность, легкая воспламеняемость, то есть малая энергия акти-вации, и повышение температуры. Кроме того, самовозгорание развивается и при наличии в веществе примеси.
Например, если в аммиачной селитре (NH4NO3) примесей нет, то ее пе-ревозка и хранение безопасны. Температура разложения лежит в пределах 200оС. Но при малых добавках органики или частиц металлов начинается ав-токаталитическое разложение, и селитра самовозгорается при 110оС. Счита-ют, что автокатализ вызывают выделяющиеся СО2 и водяной пар. Добавка масел в селитру также вызывает взрывчатое её разложение (поэтому её при-меняют для приготовления взрывчатки).
Большую роль в опасности самовозгорания играет длительность пе-риода до самовозгорания. У разных веществ она различна.
Микробиологическое самовозгорание. К микробиологическому са-мовозгоранию склонны, главным образом, материалы растительного проис-хождения. Они служат питательной средой для бактерий и грибов.
Возможности развития микробиологического процесса ограничены, так как температура самонагревания материала не должна превышать 75оС. По-скольку при более высокой температуре микроорганизмы, как правило, по-гибают. Примерами микробиологического самовозгорания можно назвать обугливание пшеницы в буртах, самонагрев навозной кучи и т. п.
В самовозгорании угля могут участвовать и адсорбция, и микроорга-низмы (в начальной стадии), и примеси. Так, существовали теории, что при-чинами самовозгорания угля является сульфиды железа (FeS), карбонаты же-леза Fe(CO)4 и др. В настоящее время считают, что в основном влияют при-меси железа, независимо от вида его химических соединений.
Основными показателями, характеризующими опасность самовозгора-ния веществ, являются рассмотренные нами в теме 4:
· температура самонагревания;
· температура тления;
· условия теплового самовозгорания;
· способность взрываться и гореть при контакте с водой, кислородом воздуха и другими окислителями.
Последний показатель качественно характеризует особую пожарную опасность веществ, называемую пирофорностью.
К пирофорным относятся вещества, имеющие температуру самовос-пламенения ниже температуры окружающей среды, в отличие от большинст-ва веществ, которые самовоспламеняются только в результате нагрева извне. Самовозгорающие вещества очень пожароопасны.
Самовозгорающие вещества можно разделить на три группы:
1. Самовозгорающиеся при соприкосновении с воздухом: фосфор, сер-нистые металлы, порошок магния, уголь, сажа и др. Например, в трассирую-щих пулях, фейерверках используются самовозгорающиеся вещества.
2. Воспламеняющиеся при соприкосновении с водой – это щелочные металлы, их карбиды, и др. Например, карбид кальция, применяемый в аце-тиленовых генераторах. Негашеная известь не горит, но выделяющееся при её реакции с водой тепло может нагреть материалы до температуры само-воспламенения.
3. К третьей группе относятся органические соединения, которые вос-пламеняются при контакте с кислородом и другими окислителями (хлором, бромом, окислами азота); это масла. Сюда относятся и вещества, получаемые в результате эндотермических реакций, например, ацетилен, которые при воздействии тепла или удара разлагаются с возможным возникновением взрыва.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 933; Нарушение авторских прав?; Мы поможем в написании вашей работы!